题目内容
16.高氯酸(HClO4)和亚氯酸钠(NaClO2)在工业上有广泛的用途,其制备工艺流程如下: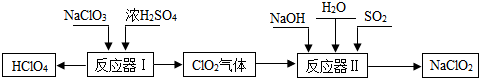
请回答下列问题:
(1)HClO4中Cl元素的化合价是+7.
(2)反应器Ⅰ中的生成物有HClO4、ClO2、NaHSO4、H2O,其中属于氧化物的是ClO2、H2O.
(3)反应器Ⅱ中发生反应的化学方程式为2ClO2+SO2+4NaOH═2NaClO2+X+2H2O,则X的化学式是Na2SO4.
分析 (1)根据在化合物中正负化合价代数和为零,结合HClO4的化学式进行解答即可.
(2)在由两种元素组成的化合物中,其中一种是氧元素的是氧化物,进行分析解答.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
解答 解:(1)氢元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×4=0,则x=+7价.
(2)ClO2、H2O是由两种元素组成且有一种是氧元素,均属于氧化物.
(3)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2ClO2+SO2+4NaOH═2NaClO2+X+2H2O,反应前氯、氧、硫、钠、氢原子个数分别为2、10、1、4、4,反应后的生成物中氯、氧、硫、钠、氢原子个数分别为2、6、0、2、4,根据反应前后原子种类、数目不变,则每个X分子由2个钠原子、1个硫原子和4个氧原子构成,则物质X的化学式为Na2SO4.
故答案为:(1)+7;(2)ClO2、H2O;(3)Na2SO4.
点评 本题难度不大,掌握化合价的原则、氧化物的特征、化学反应前后原子守恒是正确解答本题的关键.

练习册系列答案
相关题目
18.类推可以实现知识的迁移.但不符合事实的类推会得出错误的结论,下列说法正确的是( )
| A. | 硝酸铵溶于水吸收大量的热,食盐溶于水也吸收大量的热 | |
| B. | 氮肥氯化铵与碱研磨可放出氨气,氮肥尿素(CO(NH2)2)与碱研磨也能放出氨气 | |
| C. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 | |
| D. | 氢气与空气混合点燃可能爆炸,一氧化碳与空气混合点燃也可能爆炸 |
19.为减少温室气体的排放,人们积极寻找不含碳元素的燃料.经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定应用前景.其微观过程如图所示:下列说法不正确的是( )
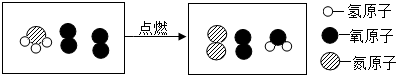

| A. | 该反应前的反应物中氮元素的化合价为-3价 | |
| B. | 该反应前后,分子的种类一定发生变化 | |
| C. | 该反应中参加反应的两种物质的质量比为17:23 | |
| D. | 该反应属于置换反应 |
4.石膏法制取硫酸钾具有能耗低,原料来源广等优点而被探索.以硫酸钙与氯化钾为原料制备硫酸钾的流程如图:

已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)
(1)氨水显碱性(填“酸性”、“碱性”或“中性”),向水中连续通氨气达两个小时可得高浓度氨水,氨气不断溶解使溶液pH增大(填“增大”、“减小”或“不变”).上表中“非常压”指需增大气压才能形成30℃的氨(35%)溶液,常压下不能形成30℃的氨(35%)溶液的原因是常压30℃时氨气在水中达到饱和时浓度小于35%.
(2)沉淀池中氨水浓度常常控制在25%至40%,其原因是氨水浓度越大,硫酸钾溶解度越小,沉淀池温度适宜保持在低温(选填“低温”或“高温”).
(3)滤液经蒸发后产生可以循环使用的气体,其化学式为NH3;滤液中的副产品氯化钙可转化成碳酸钙固体,与HNO3反应制备Ca(NO3)2•6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸溶液中溶质与溶剂的质量比为7:5.
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,其中玻璃棒在稀释浓硫酸时也用到,稀释浓硫酸时用到玻璃棒的主要作用为使溶解产生的热量及时散发,防止局部过热而引起液体飞溅.
(5)检验沉淀是否洗净的试剂是AB(填序号)
A.酚酞试液 B碳酸钠溶液 C氯化钡溶液.

已知硫酸钾在不同温度下在水溶液、氨溶液中的溶解度(g)
| 温度(℃) | 0 | 10 | 26 | 30 |
| 水溶液 | 7.31 | 9.28 | 11.03 | 12.98 |
| 氨(8%)溶液 | 1.41 | 1.58 | 2.25 | 3.36 |
| 氨(35%)溶液 | 0.44 | 0.75 | 0.82 | 非常压 |
(2)沉淀池中氨水浓度常常控制在25%至40%,其原因是氨水浓度越大,硫酸钾溶解度越小,沉淀池温度适宜保持在低温(选填“低温”或“高温”).
(3)滤液经蒸发后产生可以循环使用的气体,其化学式为NH3;滤液中的副产品氯化钙可转化成碳酸钙固体,与HNO3反应制备Ca(NO3)2•6H2O晶体,为确保制备过程中既不补充水,也无多余的水,所用硝酸溶液中溶质与溶剂的质量比为7:5.
(4)实验室进行过滤操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,其中玻璃棒在稀释浓硫酸时也用到,稀释浓硫酸时用到玻璃棒的主要作用为使溶解产生的热量及时散发,防止局部过热而引起液体飞溅.
(5)检验沉淀是否洗净的试剂是AB(填序号)
A.酚酞试液 B碳酸钠溶液 C氯化钡溶液.
8.下列加点字的含义,表示物质的是( )
| A. | 食盐加碘 | B. | 酱油加铁 | C. | 钙片 | D. | 高山缺氧 |


 如图中的A~I表示几种初中化学常贝的纯争物,A、B、C、I是单质,其他均是氧化物;C是紫红色金属,D是磁铁矿石的主要成分,固态的H叫“干冰”.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去.
如图中的A~I表示几种初中化学常贝的纯争物,A、B、C、I是单质,其他均是氧化物;C是紫红色金属,D是磁铁矿石的主要成分,固态的H叫“干冰”.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去.