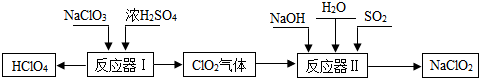
题目内容
18.类推可以实现知识的迁移.但不符合事实的类推会得出错误的结论,下列说法正确的是( )| A. | 硝酸铵溶于水吸收大量的热,食盐溶于水也吸收大量的热 | |
| B. | 氮肥氯化铵与碱研磨可放出氨气,氮肥尿素(CO(NH2)2)与碱研磨也能放出氨气 | |
| C. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 | |
| D. | 氢气与空气混合点燃可能爆炸,一氧化碳与空气混合点燃也可能爆炸 |
分析 A、根据常见物质溶于水的温度变化,进行分析判断.
B、铵态氮肥与碱性物质混合研磨后能放出有刺激性气味的气体,进行分析判断.
C、根据燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点,进行分析判断.
D、根据可燃性气体与空气混合后点燃可能发生爆炸,进行分析判断.
解答 解:A、硝酸铵溶于水吸收大量的热,食盐溶于水温度几乎无变化,故选项说法错误.
B、氮肥氯化铵与碱研磨可放出氨气,尿素(CO(NH2)2)不属于铵态氮肥,与碱研磨不能放出氨气,故选项说法错误.
C、燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点,灭火只要破坏一个条件即可,故选项说法错误.
D、氢气与空气混合点燃可能爆炸,一氧化碳也具有可燃性,与空气混合点燃也可能爆炸,故选项说法正确.
故选:D.
点评 本题难度不大,掌握铵态氮肥的化学性质、常见物质溶于水的温度变化、燃烧的条件与灭火的原理、爆炸的条件是正确解答本题的关键.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
8.人体缺少某种元素会引起甲状腺肿大,该元素是( )
| A. | 锌 | B. | 碘 | C. | 钙 | D. | 硒 |
9. 某班化学实验课进行酸碱盐的性质实验.
某班化学实验课进行酸碱盐的性质实验.
【实验一】自制酸碱指示剂
(1)取少量紫包菜和白菜叶剪碎后分别在研钵中捣烂,加入酒精溶液浸泡;用纱布将浸泡出的汁液滤出,观察到紫包菜汁液为紫色,白菜汁液为无色.分别装好待用.
(2)取四支试管分别用NaOH溶液和稀盐酸进行实验,观察到现象如图.
记录如下:
(3)再用苹果汁进行相同实验,紫包菜汁液变红色,白菜汁液变淡黄色.则苹果汁溶液显酸性.
【实验二】探究碱和盐的性质
第一组学生进行CuSO4、NaOH溶液的反应,观察到的现象是有蓝色絮状沉淀生成,溶液颜色变浅;该反应的化学方程式为CuSO4+2NaOH=Na2SO4+Cu(OH)2↓.
第二组学生进行BaCl2、Na2CO3溶液的反应,反应的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl.
【实验三】废液再探究
结束后,两组同学将全部的废液集中倒进一个废液缸中.兴趣小组同学对废液进行过滤,得到无色滤液.
【提出问题】滤液中含有什么溶质?
【做出猜想】滤液中一定含有NaCl,还可能含有BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种.
【实验探究】
(1)取少量滤液加入试管中,滴加紫包菜汁液,溶液显绿色.
(2)继续加入足量的稀硫酸,溶液变成红色,无气泡和沉淀产生,则滤液中一定没有Na2CO3、BaCl2.
根据(1)(2)判断滤液中一定含有NaOH.
(3)为最终确定该滤液的组成,还需补充的实验是:另取少量滤液于试管中,滴加BaCl2溶液,观察到白色沉淀.
【实验结论】该无色滤液的组成为NaCl、NaOH、Na2SO4.
 某班化学实验课进行酸碱盐的性质实验.
某班化学实验课进行酸碱盐的性质实验.【实验一】自制酸碱指示剂
(1)取少量紫包菜和白菜叶剪碎后分别在研钵中捣烂,加入酒精溶液浸泡;用纱布将浸泡出的汁液滤出,观察到紫包菜汁液为紫色,白菜汁液为无色.分别装好待用.
(2)取四支试管分别用NaOH溶液和稀盐酸进行实验,观察到现象如图.
记录如下:
| NaOH溶液 | 稀盐酸 | |
| 紫包菜汁液 | ①绿色 | ②红色 |
| 白菜汁液 | ③无色 | ④淡黄色 |
【实验二】探究碱和盐的性质
第一组学生进行CuSO4、NaOH溶液的反应,观察到的现象是有蓝色絮状沉淀生成,溶液颜色变浅;该反应的化学方程式为CuSO4+2NaOH=Na2SO4+Cu(OH)2↓.
第二组学生进行BaCl2、Na2CO3溶液的反应,反应的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl.
【实验三】废液再探究
结束后,两组同学将全部的废液集中倒进一个废液缸中.兴趣小组同学对废液进行过滤,得到无色滤液.
【提出问题】滤液中含有什么溶质?
【做出猜想】滤液中一定含有NaCl,还可能含有BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种.
【实验探究】
(1)取少量滤液加入试管中,滴加紫包菜汁液,溶液显绿色.
(2)继续加入足量的稀硫酸,溶液变成红色,无气泡和沉淀产生,则滤液中一定没有Na2CO3、BaCl2.
根据(1)(2)判断滤液中一定含有NaOH.
(3)为最终确定该滤液的组成,还需补充的实验是:另取少量滤液于试管中,滴加BaCl2溶液,观察到白色沉淀.
【实验结论】该无色滤液的组成为NaCl、NaOH、Na2SO4.
13.某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为( )
| A. | x+y | B. | x+y+n | C. | x-n+y | D. | x+n-y |
3.实验室常用的制取气体的装置如图:
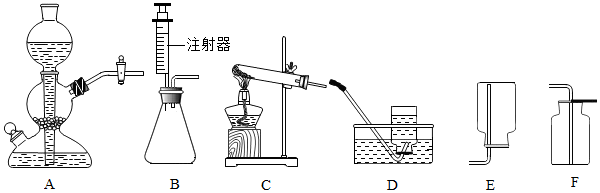
(1)用高锰酸钾制取氧气时,发生反应的方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)收集氧气时,选用装置F的依据是氧气的密度比空气大、不与空气中成分反应,选用装置D收集满的现象是集气瓶口有大气泡冒出;
(3)实验室常用氯化铵固体和碱石灰固体共热来制取氨气,常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水,其水溶液呈碱性,制取并收集氨气,应从如图中选择的发生装置是C,收集装置是E;
(4)在实验室制取二氧化碳的研究中.进行了如下实验:
①上述实验中反应的化学方程式是CaCO3+2HCl═CaCl2+H2O+CO2↑.
②若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙(填试验编号)对照.
③除盐酸的浓度外,上述实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积).
④表中的两个实验.尽管在原料状态、发生装置等方面存在差异,却都能控制气体比较平稳地 产生,请从原枓、操作等方面思考,阐述下表实验中气体比较平稳产生的最主要的一个原因.

(1)用高锰酸钾制取氧气时,发生反应的方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)收集氧气时,选用装置F的依据是氧气的密度比空气大、不与空气中成分反应,选用装置D收集满的现象是集气瓶口有大气泡冒出;
(3)实验室常用氯化铵固体和碱石灰固体共热来制取氨气,常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水,其水溶液呈碱性,制取并收集氨气,应从如图中选择的发生装置是C,收集装置是E;
(4)在实验室制取二氧化碳的研究中.进行了如下实验:
| 药品、实验编号 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
②若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙(填试验编号)对照.
③除盐酸的浓度外,上述实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积).
④表中的两个实验.尽管在原料状态、发生装置等方面存在差异,却都能控制气体比较平稳地 产生,请从原枓、操作等方面思考,阐述下表实验中气体比较平稳产生的最主要的一个原因.
| 目的 | 原料 | 发生装置 | 气体比较平稳产生的最主要一个原因 |
| 制取二氧化碳 | 块状大理石 稀盐酸 | A | |
| 制取氧气 | 粉末状二氧化锰 3%的过氧化氢溶液 | B |
7.下列说法正确的是( )
| A. | 含有碳元素的物质都是有机物 | |
| B. | 合金的硬度一般比各成分金属小 | |
| C. | 用灯帽盖灭酒精灯,是为了降低可燃物的温度 | |
| D. | 室内开花,墙外可以嗅到花香,说明分子在不断的运动 |