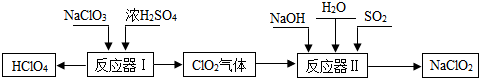
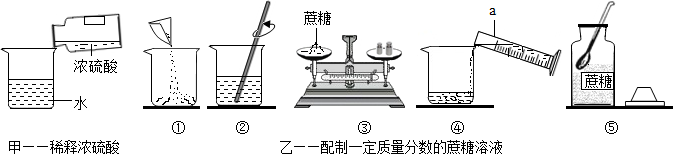
题目内容
1.如图1是甲、乙、丙三种固态物质的溶解度曲线.
(1)t2℃时,将10g甲放入10g水中得到溶液的质量为15g.
(2)将 t2℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质分数由大到小的顺序是
乙>甲>丙.
(3)将t1℃时,将盛有丙的饱和溶液的小试管放入盛水的烧杯中(如图2),向水中缓缓倒入一定量的浓硫酸后,试管内溶液中有固体析出,其原因是浓硫酸溶于水,使溶液的温度升高,丙的溶解度减小,从而析出溶质.
分析 (1)据该温度下甲的溶解度分析判断;
(2)据甲乙丙三种物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数计算方法解答;
(3)浓硫酸溶于水放热,丙的溶解度随温度升高而减小.
解答 解:(1)t2℃时甲的溶解度是50g,即100g水中最多溶解50g的甲,所以将10g甲放入10g水中最多溶解5g,得到溶液的质量为15g;
(2)将 t2℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,甲乙的溶解度减小,析出溶质,溶剂的质量不变,溶质的质量分数减小,而丙的溶解度增大,则溶液中溶质、溶剂质量不变,溶质质量分数与降温前相等;饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,即溶解度大则溶质的质量分数大,而t1℃乙的溶解度大于甲的溶解度大于降温前丙的溶解度,故所得溶液中溶质的质分数由大到小的顺序是乙>甲>丙;
(3)将t1℃时,将盛有丙的饱和溶液的小试管放入盛水的烧杯中,向水中缓缓倒入一定量的浓硫酸后,由于浓硫酸溶于水放热,则溶液温度升高,丙的溶解度减小,试管内溶液中有固体析出;
故答案为:(1)15;(2)乙>甲>丙;(3)浓硫酸溶于水,使溶液的温度升高,丙的溶解度减小,从而析出溶质.
点评 了解溶解度概念、溶解度曲线的意义、饱和溶液中溶解度大则溶质的质量分数大、浓硫酸溶于水放热是解答此题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.实验室常用的制取气体的装置如图:
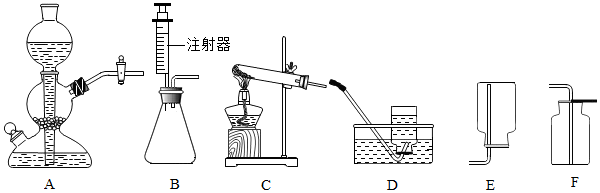
(1)用高锰酸钾制取氧气时,发生反应的方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)收集氧气时,选用装置F的依据是氧气的密度比空气大、不与空气中成分反应,选用装置D收集满的现象是集气瓶口有大气泡冒出;
(3)实验室常用氯化铵固体和碱石灰固体共热来制取氨气,常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水,其水溶液呈碱性,制取并收集氨气,应从如图中选择的发生装置是C,收集装置是E;
(4)在实验室制取二氧化碳的研究中.进行了如下实验:
①上述实验中反应的化学方程式是CaCO3+2HCl═CaCl2+H2O+CO2↑.
②若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙(填试验编号)对照.
③除盐酸的浓度外,上述实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积).
④表中的两个实验.尽管在原料状态、发生装置等方面存在差异,却都能控制气体比较平稳地 产生,请从原枓、操作等方面思考,阐述下表实验中气体比较平稳产生的最主要的一个原因.

(1)用高锰酸钾制取氧气时,发生反应的方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)收集氧气时,选用装置F的依据是氧气的密度比空气大、不与空气中成分反应,选用装置D收集满的现象是集气瓶口有大气泡冒出;
(3)实验室常用氯化铵固体和碱石灰固体共热来制取氨气,常温下氨气是一种无色、有刺激性气味的气体,密度比空气小,氨气极易溶于水,其水溶液呈碱性,制取并收集氨气,应从如图中选择的发生装置是C,收集装置是E;
(4)在实验室制取二氧化碳的研究中.进行了如下实验:
| 药品、实验编号 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
②若要研究盐酸浓度大小对反应的影响,可选择实验甲与乙(填试验编号)对照.
③除盐酸的浓度外,上述实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积).
④表中的两个实验.尽管在原料状态、发生装置等方面存在差异,却都能控制气体比较平稳地 产生,请从原枓、操作等方面思考,阐述下表实验中气体比较平稳产生的最主要的一个原因.
| 目的 | 原料 | 发生装置 | 气体比较平稳产生的最主要一个原因 |
| 制取二氧化碳 | 块状大理石 稀盐酸 | A | |
| 制取氧气 | 粉末状二氧化锰 3%的过氧化氢溶液 | B |
9.苯甲酸是一种食品防腐剂,它是一种片状晶体,在水中的溶解度如表:
某同学为了提纯某一苯甲酸样品(其中含泥沙等难溶于水的杂质),进行了如下实验:
(1)取样品约1g放入烧杯中,加入50mL蒸馏水充分搅拌,发现样品几乎没溶解,原因是常温下苯甲酸溶解度很小.
(2)将烧杯放在石棉网上加热,将样品充分溶解后,在加入少量蒸馏水,然后趁热过滤.趁热过滤的目的是减小过滤时苯甲酸的损失.
(3)将所得滤液缓慢降温至室温,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体.
| 温度℃ | 25 | 50 | 95 |
| 溶解度g | 0.17 | 0.95 | 6.8 |
(1)取样品约1g放入烧杯中,加入50mL蒸馏水充分搅拌,发现样品几乎没溶解,原因是常温下苯甲酸溶解度很小.
(2)将烧杯放在石棉网上加热,将样品充分溶解后,在加入少量蒸馏水,然后趁热过滤.趁热过滤的目的是减小过滤时苯甲酸的损失.
(3)将所得滤液缓慢降温至室温,使苯甲酸以晶体形式析出,然后过滤得到较纯净的苯甲酸晶体.
6.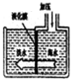 淡水海水可采用膜分离技术(如图),水分子可以透过膜(海水中其他粒子不能透过)进入左侧的池子,从而得到淡水,以下分析中不正确的是( )
淡水海水可采用膜分离技术(如图),水分子可以透过膜(海水中其他粒子不能透过)进入左侧的池子,从而得到淡水,以下分析中不正确的是( )
 淡水海水可采用膜分离技术(如图),水分子可以透过膜(海水中其他粒子不能透过)进入左侧的池子,从而得到淡水,以下分析中不正确的是( )
淡水海水可采用膜分离技术(如图),水分子可以透过膜(海水中其他粒子不能透过)进入左侧的池子,从而得到淡水,以下分析中不正确的是( )| A. | 这种淡化膜不可用滤纸代替 | B. | 左侧池中的淡水属于软水 | ||
| C. | 右侧池中溶剂的质量不变 | D. | 右侧池中海水的溶质质量分数增大 |
13.下列关于氧气的说法正确的是( )
| A. | 氧气能支持燃烧,可作燃料 | |
| B. | 水生生物能依靠溶于水中的氧气而生存是由于氧气易溶于水 | |
| C. | 氧气能跟所有物质发生氧化反应,物质在氧气中燃烧的反应一定是化合反应 | |
| D. | 氧气和臭氧(O3)都是氧元素形成的单质 |
11.常温下,下列说法正确的是( )
| A. | 碳酸钠溶液使石蕊溶液变红 | B. | 溶液pH由8变到11,其碱性减弱 | ||
| C. | 胃酸过多的人应少饮用苹果汁 | D. | 溶液pH由5变到2,其酸性减弱 |