题目内容
5.煤、石油燃烧释放到大气中的SO2会在空气中转化成H2SO4,形成硫酸型酸雨,污染环境.根据要求回答下列问题:(1)在空气中尘埃等的催化作用下SO2会与氧气反应生成SO3,SO3与水反应生成H2SO4,这两个化学反应均属于化合反应(填反应基本类型).
(2)以化合价为纵坐标,物质的类别为横坐标所绘制的图象叫价类图.图1为硫的价类图,图中a表示的物质类别是单质.SO2→SO3→H2SO4,的变化过程可用价类图中的序号表示为:b→c→e.
(3)近年来,有人提出可用海水(含NaCl)来处理火电厂、硫酸厂等工厂废气中的SO2,处理流程图如图2所示:

①NaOH溶液吸收废气中的SO2生成Na2SO3,该反应的化学方程式是2NaOH+SO2═Na2SO3+H2O;
②将SO2通入NaOH溶液得到Na2SO3,再与HCl反应生成SO2.这一变化过程中,硫元素的变化可用(2)中价类图中的序号表示为b→f→b.
分析 (1)反应类型有四个:化合反应、分解反应、置换反应和复分解反应.化合反应是多种物质反应,只生成一种物质的化学反应.
(2)根据单质中元素的化合价为零;
(3)①确定反应的反应物、生成物及反应条件,完成反应的化学方程式书写;②根据硫元素的变化进行分析解答.
解答 解:
(1)在空气中尘埃等的催化作用下SO2会与氧气反应生成SO3,SO3与水反应生成H2SO4,即:SO2+H2O→H2SO3,H2SO3+O2→H2SO4,都是由两种物质反应生成一种物质,故属于化合反应;
(2)单质中元素的化合价为零,由图示可知A点物质的化合价是零,所以物质类别是单质;SO2→SO3→H2SO4,的变化过程中,硫元素的化合价由+4→+6
→+6,可用价类图中的序号表示为:b→c→e.
(3)①NaOH溶液吸收SO2生成亚硫酸钠和水,反应的化学方程式为2NaOH+SO2═Na2SO3+H2O;
②将SO2通人NaOH溶液得到Na2SO3,再与HCl反应生成SO2.SO2为氧化物,这一变化过程中,硫元素的化合价由+4→+4→+4,可用价类图中的序号表示为:b→f→b.
答案:
(1)化合;
(2)单质;c;
(3)①2NaOH+SO2═Na2SO3+H2O;②b→f→b.
点评 解答本题关键是要知道单质化合价是零,化学式的书写方法:正价在前负价在后,十字交叉再约简,熟悉化学方程式的书写方法.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
16.甲同学在做铁与流速溶液反应的实验时,发现生成的气体有刺激性气味,于是进行了如下探究.
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去.SO2与二氧化碳相似,能与氢氧化钠反应.
(3)点燃充满氢气的小试管,会有轻微的爆鸣声.
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产物中可能有二氧化硫.
【实验探究】小明用图甲所示的装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.

请帮助小明填写如表:
【实验结论】铁与不同浓度的硫酸溶液反应,生成的气体产物可能不同,当硫酸浓度达到足够大时,生成的气体产物中有二氧化硫.
【反思】
(1)写出实验三中铁与硫酸反应的化学方程式:Fe+H2SO4═FeSO4+H2↑;.
(2)实验一中C装置的作用是吸收二氧化硫.发生的反应的化学方程式:SO2+2NaOH═Na2SO3+H2O.
【拓展延伸】
(3)实验结束后甲同学先撤去了酒精灯,请你预测会发生什么后果引起倒吸现象,B中液体会倒吸入A,A处热试管有可能炸裂.
【提出问题】铁与硫酸溶液反应生成的气体为什么有刺激性气味?
【查阅资料】
(1)6H2SO4(浓)+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O+3SO2↑
(2)SO2可使品红溶液的红色褪去.SO2与二氧化碳相似,能与氢氧化钠反应.
(3)点燃充满氢气的小试管,会有轻微的爆鸣声.
【进行猜想】铁与不同浓度的硫酸溶液反应,生成的气体产物中可能有二氧化硫.
【实验探究】小明用图甲所示的装置进行实验,并将E中收集到的气体进行如图乙所示的爆鸣实验.

请帮助小明填写如表:
| A中硫 酸浓度 | 实验现象 | A中生成气体成分 | |||
| B中品 红溶液 | D中品 红溶液 | 爆鸣实验 | |||
| 实验一 | 98% | 褪色 | 不褪色 | 无爆鸣声 | 只有SO2 |
| 实验二 | 45% | 稍有褪色 | 不褪色 | 有爆鸣声 | SO2、H2都有 |
| 实验三 | 25% | 不褪色 | 不褪色 | 有爆鸣声 | 只有H2 |
【反思】
(1)写出实验三中铁与硫酸反应的化学方程式:Fe+H2SO4═FeSO4+H2↑;.
(2)实验一中C装置的作用是吸收二氧化硫.发生的反应的化学方程式:SO2+2NaOH═Na2SO3+H2O.
【拓展延伸】
(3)实验结束后甲同学先撤去了酒精灯,请你预测会发生什么后果引起倒吸现象,B中液体会倒吸入A,A处热试管有可能炸裂.
13.下列有关于氧气的说法中错误的是( )
| A. | 氧气供给呼吸,它和人体内物质反应,放出热量,维持生命活动 | |
| B. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| C. | 分离液态空气得到氧气的过程属于物理变化 | |
| D. | 夏天鱼池内开启增氧泵,是因为温度升高,氧气在水中的溶解量减少 |
20.生产、生活离不开化学知识.下列做法或行为中,正确的是( )
| A. | 用粮食酿造的米醋作调味剂 | |
| B. | 杜绝吃含有化学物质的食品 | |
| C. | 随意进入废弃的矿洞内游玩 | |
| D. | 在不通风的澡室里用燃气热水器洗澡 |
10.某兴趣小组对实验室制备氧气的反应条件进行如下探究实验.
(1)为探究不同催化剂对氯酸钾分解速度的影响,甲设计以下对比实验探究,在相同温度下,比较两组实验产生O2的快慢.
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将x g KClO3与1.0g CuO均匀混合加热
实验中Ⅱ中x的值应为3.0g;Ⅰ中反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
实验结论:在其他条件相同的情况下,MnO2的催化能力比CuO强.
(2)乙探究了影响双氧水分解速度的某种因素.实验数据记录和可选装置如表:
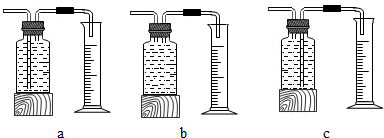
本实验中,测量O2体积的装置应该是C(填编号);
实验结论:乙探究中,在其他条件相同的情况下,双氧水的浓度越大,双氧水分解得越快.
(1)为探究不同催化剂对氯酸钾分解速度的影响,甲设计以下对比实验探究,在相同温度下,比较两组实验产生O2的快慢.
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将x g KClO3与1.0g CuO均匀混合加热
实验中Ⅱ中x的值应为3.0g;Ⅰ中反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
实验结论:在其他条件相同的情况下,MnO2的催化能力比CuO强.
(2)乙探究了影响双氧水分解速度的某种因素.实验数据记录和可选装置如表:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |

本实验中,测量O2体积的装置应该是C(填编号);
实验结论:乙探究中,在其他条件相同的情况下,双氧水的浓度越大,双氧水分解得越快.
17.对二甲苯(简称PX)的化学式是C8H10,无色透明液体,具有芳香气味,可燃,其蒸气与空气可形成爆炸性混合物.下列有关对二甲苯的说法中,正确的是( )
| A. | 对二甲苯属于有机高分子化合物 | |
| B. | 对二甲苯中碳元素的质量分数大于甲烷中碳元素的质量分数 | |
| C. | 对二甲苯是由8个碳原子和10个氢原子构成 | |
| D. | 对二甲苯中碳元素、氢元素的质量比为4:5 |

 同学们到化学实验做实验时,常常闻到刺鼻难闻的气味,这是由于化学实验室要排放成分复杂的污染物.某校化学兴趣小组的同学在甲实验室中进行氧气分别与碳,硫,铁反应的实验后,为了解该实验产生的气体对空气成分造成的影响,接着设计了如下实验装置进行实验(图中多孔气泡的作用是增大气体与溶液的接触面积,使反应充分进行).
同学们到化学实验做实验时,常常闻到刺鼻难闻的气味,这是由于化学实验室要排放成分复杂的污染物.某校化学兴趣小组的同学在甲实验室中进行氧气分别与碳,硫,铁反应的实验后,为了解该实验产生的气体对空气成分造成的影响,接着设计了如下实验装置进行实验(图中多孔气泡的作用是增大气体与溶液的接触面积,使反应充分进行).