题目内容
1.溶解是生活中常见的现象,不同物质在水中的溶解能力不同.①下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水).
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
Ⅱ.从NaCl溶液中得到NaCl晶体的方法是蒸发结晶.
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).

Ⅲ.所得三种溶液中:一定属于饱和溶液的是A,溶液中溶质质量分数的大小关系是C>B>A.
分析 ①根据20℃时,氯化钠的溶解度进行分析;
根据氯化钠的溶解度受温度的影响变化较小进行分析;
②根据饱和溶液的判断方法,以及溶液中溶剂的质量进行分析.
解答 解:①20℃时,氯化钠的溶解度是36克,所以将20g NaCl放入50g水中,所得溶液的质量是50g+18g=68g;
氯化钠的溶解度受温度的影响变化较小,所以从NaCl溶液中得到NaCl晶体的方法是蒸发结晶;
②通过分析可知,A烧杯底部有固体,所以一定属于饱和溶液的是A,B中的溶质是40mL,C中的溶剂是20mL,A中的硫酸铜会形成硫酸铜晶体,所以溶液中溶质质量分数的大小关系是:C>B>A.
故答案为:①68;蒸发结晶;
②A,C>B>A.
点评 本题难度不大,掌握理解溶解度的概念、结晶的方法并能灵活运用是正确解答本题的关键.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
11.下列在试管进行的有关操作正确的是( )
| A. |  加热液体 | B. |  收集气体 | C. |  加固体粉末 | D. |  滴加液体 |
12.下列有关水的说法正确的是( )
| A. | 净化水的方法有吸附、沉降、过滤和蒸发等 | |
| B. | 水通电分解产生的正极和负极的气体体积比为2:1 | |
| C. | 为了增强水的导电性在电解水实验中需加入少量氯化钠 | |
| D. | 为了防止水结冰可在汽车水箱中加入少量乙二醇 |
9.下表列出的是每100g某品种西瓜可食用部分的主要营养成分数据.
(1)表中“X“是指有机营养素中的蛋白质.
(2)“钙、磷、铁、锌17.1mg”是指元素(填“单质”或“元素”)的质量,缺钙(填元素名称)可引起幼儿童佝偻症.
(3)检验西瓜中是否含有淀粉可选用碘水(或碘酒)(填试剂名称)滴在食物样品上,观察是否变成
蓝色;淀粉在人体内需转化为可直接吸收的化合物是葡萄糖,再经过氧化分解向人体提供能量.
(4)下列食品中富含蛋白质的是b.(填序号)
a.菠菜 b.鸡蛋 c.花生油 d.米饭.
| 营养成分 | 水分 | X | 脂肪 | 糖类 | 维生素 | 钙、磷、铁、锌 |
| 质量 | 92.5g | 0.7g | 0.2g | 6.1g | 6.8mg | 17.1mg |
(2)“钙、磷、铁、锌17.1mg”是指元素(填“单质”或“元素”)的质量,缺钙(填元素名称)可引起幼儿童佝偻症.
(3)检验西瓜中是否含有淀粉可选用碘水(或碘酒)(填试剂名称)滴在食物样品上,观察是否变成
蓝色;淀粉在人体内需转化为可直接吸收的化合物是葡萄糖,再经过氧化分解向人体提供能量.
(4)下列食品中富含蛋白质的是b.(填序号)
a.菠菜 b.鸡蛋 c.花生油 d.米饭.
16. 化学实验小组在做二氧化碳和氢氧化钠溶液反应的趣味实验.查阅资料如下:
化学实验小组在做二氧化碳和氢氧化钠溶液反应的趣味实验.查阅资料如下:
表1 NaOH、Na2CO3和NaCl在水中的溶解度(20℃)
表2 NaOH、Na2CO3和NaCl在乙醇中的溶解度(“-”表示几乎不溶)
按照如图装置进行实验:
Ⅰ.向烧杯中加入试剂a.向2支试管中分别加入20mL一定溶质质量分数的氢氧化钠的水溶液(试管1)和20mL饱和的氢氧化钠的乙醇溶液(试管2).
Ⅱ.分别通入适量的二氧化碳.
Ⅲ.再分别滴加稀盐酸.
关于该实验有以下分析与解释:
①通入适量的二氧化碳时试管2中NaOH与CO2反应的化学方程式为2NaOH+CO2═Na2CO3↓+H2O.
②烧杯中出现浑浊,则试剂a为澄清石灰水.
③通入二氧化碳后,试管1、2中的现象明显相同.
④通过上述实验,对于没有明显现象的反应,可以通过证明有新物质的生成来证明反应的发生.
⑤新物质的生成,可以利用化学性质来证明,也可以用其物理性质证明.
以上说法正确的是( )
 化学实验小组在做二氧化碳和氢氧化钠溶液反应的趣味实验.查阅资料如下:
化学实验小组在做二氧化碳和氢氧化钠溶液反应的趣味实验.查阅资料如下:表1 NaOH、Na2CO3和NaCl在水中的溶解度(20℃)
| T/℃ | NaOH | Na2CO3 | NaCl |
| 20 | 109 | 21.8 | 36.0 |
| T/℃ | NaOH | Na2CO3 | NaCl |
| 20 | 17.3 | - | 0.1 |
Ⅰ.向烧杯中加入试剂a.向2支试管中分别加入20mL一定溶质质量分数的氢氧化钠的水溶液(试管1)和20mL饱和的氢氧化钠的乙醇溶液(试管2).
Ⅱ.分别通入适量的二氧化碳.
Ⅲ.再分别滴加稀盐酸.
关于该实验有以下分析与解释:
①通入适量的二氧化碳时试管2中NaOH与CO2反应的化学方程式为2NaOH+CO2═Na2CO3↓+H2O.
②烧杯中出现浑浊,则试剂a为澄清石灰水.
③通入二氧化碳后,试管1、2中的现象明显相同.
④通过上述实验,对于没有明显现象的反应,可以通过证明有新物质的生成来证明反应的发生.
⑤新物质的生成,可以利用化学性质来证明,也可以用其物理性质证明.
以上说法正确的是( )
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②④⑤ | D. | ①②③⑤ |
6.以下是几个常见实验的注意事项:
①在试管中加热胆矾固体,试管口要略低于试管底部
②铁丝在氧气中燃烧,集气瓶中要预先放入少量水
③氯酸钾制氧气实验完毕,先将导管移出水槽再停止加热
它们的目的都是为了防止( )
①在试管中加热胆矾固体,试管口要略低于试管底部
②铁丝在氧气中燃烧,集气瓶中要预先放入少量水
③氯酸钾制氧气实验完毕,先将导管移出水槽再停止加热
它们的目的都是为了防止( )
| A. | 水倒流 | B. | 温度过高 | C. | 炸裂反应容器 | D. | 反应过慢 |
10.黎老师在课堂上给同学们出了一道计算题,让同学们练习.题目如下:
扣扣同学用锌和稀硫酸制取氢气,他向发生装置中加入一定量锌粒,将30g稀硫酸分三次加入,每次产生气体的质量如下表.
(1)共制得氢气多少克?
(2)试计算所用稀硫酸的溶质质量分数为多少.
黎老师收集同学们的练习发现,第一小题的答案,全班没有异议;第二小题的答案,全班出现两种结果,①16.3%和②19.6%.你需要回答的问题是:
(1)共制得氢气0.1g.
(2)第二小题你同意的结果是②(填序号).
(3)写出第二小题的完整计算过程.
扣扣同学用锌和稀硫酸制取氢气,他向发生装置中加入一定量锌粒,将30g稀硫酸分三次加入,每次产生气体的质量如下表.
| 次数 | 第一次 | 第二次 | 第三次 |
| 加入稀硫酸质量/g | 10 | 10 | 10 |
| 生成氢气质量/g | 0.04 | 0.04 | 0.02 |
(2)试计算所用稀硫酸的溶质质量分数为多少.
黎老师收集同学们的练习发现,第一小题的答案,全班没有异议;第二小题的答案,全班出现两种结果,①16.3%和②19.6%.你需要回答的问题是:
(1)共制得氢气0.1g.
(2)第二小题你同意的结果是②(填序号).
(3)写出第二小题的完整计算过程.
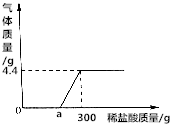 取24.8gCaCO3和Ca(OH)2固体混合物于烧杯中,向烧杯中不断加入质量分数为7.3%的稀盐酸.反应过程中测得生成气体的质量与所加稀盐酸质量的关系如图所示.
取24.8gCaCO3和Ca(OH)2固体混合物于烧杯中,向烧杯中不断加入质量分数为7.3%的稀盐酸.反应过程中测得生成气体的质量与所加稀盐酸质量的关系如图所示.