题目内容
11.日本311大地震后灾区为预防传染病的常用方法是消毒,常见的碱类物质、甲醛等都有较好的杀死病毒的作用.其中NaOH溶液因消毒效果好且廉价易得被广泛使用,从而使工业烧碱用量增加.但工业烧碱中含有杂质碳酸钠,为了测定氢氧化钠的质量分数,某工厂甲、乙两实验员分别设计了实验方案:甲的方案是:
准确称量一定质量的烧碱样品(记为m1)于烧杯中加蒸馏水溶解,再加入过量氯化钡溶液至沉淀完全,然后过滤、洗涤、烘干、称量得到的沉淀(记为m2).
(1)此反应的方程式为:BaCl2+Na2CO3═2NaCl+BaCO3↓,用上述字母表示此烧碱样品中氢氧化钠的质量分数$\frac{19700m1-10600m2}{197m1}$%;
(2)若该工业烧碱中氢氧化钠的质量分数为80%,某养殖户需配制2000g2%的氢氧化钠溶液对禽舍进行杀菌消毒,需要这种工业烧碱50g.
乙的方案如下图所示:
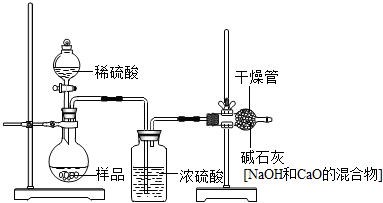
(1)根据乙的实验装置图分析,浓硫酸的作用是吸水,碱石灰的作用是吸收二氧化碳.
(2)小明认为按照乙的方案进行测定,会导致不可避免的误差,例如:装置内空气中的CO2没有排出;反应产生的CO2未被完全吸收等.该设计中还有一个因素也会导致不可避免的误差,你认为是下列因素中的(填序号)③.
①装置的气密性不好 ②加入的稀硫酸量不足 ③干燥管与空气直接相通.
分析 甲的方案:
(1)依据氯化钡与碳酸钠反应生成碳酸钡和氯化钠书写方程式,此烧碱样品中碳酸钠的质量可根据碳酸钡的质量m2来求出,从而求出此烧碱样品中氢氧化钠的质量分数.
(2)根据加水稀释前后溶液中溶质质量不变,计算加水稀释所需要浓溶液的质量.
乙的方案:
(1)根据物质的性质及连接方式,分析装置图中浓硫酸和碱石灰的作用;
(2)根据物质的性质及连接方式,对装置产生的误差进行分析.
解答 解:甲的方案:
(1)依据氯化钡与碳酸钠反应生成碳酸钡和氯化钠书写方程式为:BaCl2+Na2CO3═2NaCl+BaCO3↓,
设碳酸钠的质量为x
BaCl2+Na2CO3═2NaCl+BaCO3↓,
106 197
x m2
$\frac{106}{197}$=$\frac{x}{m2}$
x=$\frac{106m2}{197}$
那么此烧碱样品中氢氧化钠的质量是:m1-x=$\frac{197m1-106m2}{197}$
此烧碱样品中氢氧化钠的质量分数=$\frac{197m1-106m2}{197m1}$×100%=$\frac{19700m1-10600m2}{197m1}$%;
(2)设需要这种工业烧碱的质量为x
x•80%=2000g×2%
解得:x=50g
乙的方案:
(1)浓硫酸有吸水性,在装置中放置于碱石灰前,防止混在气体中的水分对测定气体二氧化碳产生影响;碱石灰可吸收二氧化碳,因此装置中的碱石灰用来吸收反应产生的二氧化碳;
(2)由于装置中不可避免地会存在二氧化碳的残留,因此该装置存在测定不精确的不可避免的误差;而且碱石灰与大气相通,空气中的二氧化碳也会与碱石灰发生反应,从而造成测定误差,此误差因装置关系而无法避免,分析所给的选项可以知道选项③符合刚才的分析,故选③;
故本题答案为:甲的方案:
(1)BaCl2+Na2CO3═2NaCl+BaCO3↓;$\frac{19700m1-10600m2}{197m1}$%;
(2)50;
乙的方案:
(1)吸水;吸收反应产生的二氧化碳;
(2)③.
点评 在解此类题时,首先弄懂题意,从大量的叙述中找出有用的,此类题的起点高,但是落点低,答案大都是平时学过的,难度不大.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. |  取用固体药品 | B. |  熄灭酒精灯 | ||
| C. |  稀释浓硫酸 | D. |  检查装置的气密性 |
| A. | 6 | B. | 9 | C. | 11 | D. | 13 |
| A. | 氧气是植物光合作用的原料来源 | |
| B. | 氧气在低温、高压的条件下可以转变为液体或固体 | |
| C. | 氧气的化学性质活泼,是可燃物 | |
| D. | 因为氮气和氧气的密度不同,所以工业上用分离液态空气的方法制氧气 |
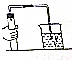 检查装置的气密性(如图),连接好仪器,先将导管的一端浸没在水里,然后双手紧贴容器外壁,若导管口有气泡冒出,移开手,在导管内形成一段水柱,则不漏气.
检查装置的气密性(如图),连接好仪器,先将导管的一端浸没在水里,然后双手紧贴容器外壁,若导管口有气泡冒出,移开手,在导管内形成一段水柱,则不漏气.
 如图为某医用葡萄糖注射液商标的一部分,请回答:
如图为某医用葡萄糖注射液商标的一部分,请回答: