题目内容
6.有一包白色固体粉末,可能含有硝酸钡、氯化钠、氢氧化钠、硫酸钠、硫酸铜中的一种或几种,对该固体进行如下实验: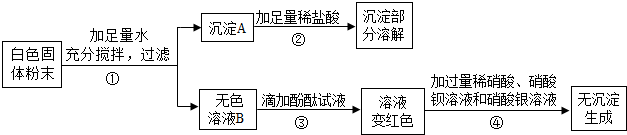
请回答下列问题:
(1)原白色固体粉末中一定含有CuSO4、Ba(NO3)2、NaOH,可能含有Na2SO4.
(2)无色溶液B中一定含有的溶质有NaOH、NaNO3.
(3)写出步骤②中发生反应的化学方程式Cu(OH)2+2HCl═CuCl2+2H2O.
分析 根据硫酸根离子会与钡离子结合生成难溶于酸的硫酸钡沉淀,铜离子和氢氧根离子生成的氢氧化铜沉淀可以溶于酸,氯离子和银离子生成的氯化银沉淀难溶于酸进行分析.
解答 解:(1)取白色固体加入足量的水溶解、过滤后得到沉淀A和无色溶液B,在沉淀A中,加入足量的稀盐酸,沉淀部分溶解,硫酸铜和氢氧化钠会生成氢氧化铜沉淀和硫酸钠,氢氧化铜沉淀会溶于盐酸,硫酸铜和硝酸钡反应生成硫酸钡沉淀和硝酸铜,硫酸钡沉淀不溶于酸,所以白色固体中一定存在硫酸铜、氢氧化钠、硝酸钡;在无色溶液B中,滴加酚酞试液,溶液变红,说明B溶液中存在氢氧化钠,向溶液中依次加入过量的稀硝酸、硝酸钡溶液和适量硝酸银溶液,无沉淀生成,氯化钠和硝酸银会生成氯化银沉淀和硝酸钠,氯化银沉淀难溶于硝酸,所以白色固体中不存在氯化钠,白色固体中是否存在硫酸钠,对实验现象不会造成影响,所以白色固体中可能含有硫酸钠,所以原白色固体中一定含有:CuSO4、Ba(NO3)2、NaOH,一定没有:NaCl,可能含有:Na2SO4;
故答案为:CuSO4、Ba(NO3)2、NaOH;Na2SO4;
(2)无色酚酞在碱性溶液中显红色,在无色溶液B中,滴加酚酞试液,溶液变红,结合(1)中的分析,说明B溶液中含有过量的氢氧化钠、反应生成的硝酸钠;
故答案为:NaOH、NaNO3;
(3)步骤②沉淀溶解时氢氧化铜和盐酸反应产生氯化铜和水,故反应的方程式为:Cu(OH)2+2HCl═CuCl2+2H2O.
点评 本题为框图式推断题,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
17.以下实验现象描述不正确的是( )
| A. | 铁丝在氧气中燃烧,火星四射 | B. | 红磷在空气中燃烧产生大量白烟 | ||
| C. | 镁条在空气中燃烧发出耀眼的白光 | D. | 硫粉在氧气中燃烧产生淡蓝色火焰 |
1. 如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
 如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )
如图是氢氧化钠溶液与稀硫酸反应时,溶液的pH变化曲线图.下列说法正确的是( )| A. | 该实验是将稀硫酸滴入氢氧化钠溶液中 | |
| B. | 曲线上A点的溶液里溶质有H2SO4、Na2SO4和NaOH | |
| C. | 取曲线上M点的溶液,向其中滴入无色酚酞试液,溶液变红色 | |
| D. | 曲线上B点的溶液里溶质有两种 |
11.完成对四组无色溶液成分探究后,小江记录了以下四组数据,其中没有错误的一组是( )
| A. | H2SO4 Na2SO4 KNO3 | B. | CuSO4 H2SO4 NaCl | ||
| C. | NaOH NaCl HCl | D. | H2SO4 Na2CO3 NaNO3 |
18.碳酸钠和碳酸氢钠是生活中常见的盐.通过实验验证、探究它们的化学性质.
【查阅资料】
①Na2CO3+CaCl2=CaCO3↓+2NaCl
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
③Ca(HCO3)2易溶于水.
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合的现象(表中的百分数为溶液中溶质的质量分数):
【进行实验】
【解释与结论】
(1)实验1中,NaHCO3与盐酸反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑.
(2)实验2中,试剂a为澄清的石灰水.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为:2NaHCO3+CaCl2=CaCO3↓+2NaCl+CO2↑+H2O.
【反思与评价】
(1)实验2中,加热NaHCO3后,试管I中残留固体成分可能为Na2CO3;Na2CO3,NaHCO3(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊,未观察到气泡,原因可能是CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡.
(3)用2中不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:①各取少量0.1%的NaHCO3和Na2CO3加入等质量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3.②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
【查阅资料】
①Na2CO3+CaCl2=CaCO3↓+2NaCl
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
③Ca(HCO3)2易溶于水.
④CaCl2溶液分别与NaHCO3、Na2CO3溶液等体积混合的现象(表中的百分数为溶液中溶质的质量分数):
| NaHCO3 | Na2CO3 | ||||
| 0.1% | 1% | 5% | 0.1% | ||
| CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
| 1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
| 5% | 无明显现象 | 有浑浊 | 有沉淀,有大量气泡 | 有沉淀 | |
| 序号 | 实验装置 | 主要实验步骤 | 实验现象 |
| 实验1 |  | 向2支试管中分别加入少量Na2CO3和NaHCO3溶液,再分别滴加盐酸 | 2支试管中均有气泡产生 |
| 实验2 | 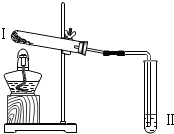 | 向II中加入试剂a,向I中加入少量Na2CO3或NaHCO3固体,分别加热一段时间 | Na2CO3受热时II中无明显现象 NaHCO3受热时II中出现浑浊 |
| 实验3 | 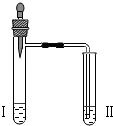 | 向II中加入试剂a,向I中加入少量5%的NaHCO3溶液,再滴加5%的CaCl2溶液 | I中出现浑浊,有气泡产生 II中出现浑浊 |
(1)实验1中,NaHCO3与盐酸反应的化学方程式为NaHCO3+HCl═NaCl+H2O+CO2↑.
(2)实验2中,试剂a为澄清的石灰水.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为:2NaHCO3+CaCl2=CaCO3↓+2NaCl+CO2↑+H2O.
【反思与评价】
(1)实验2中,加热NaHCO3后,试管I中残留固体成分可能为Na2CO3;Na2CO3,NaHCO3(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊,未观察到气泡,原因可能是CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡.
(3)用2中不同的方法鉴别Na2CO3和NaHCO3固体,实验方案分别为:①各取少量0.1%的NaHCO3和Na2CO3加入等质量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3.②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
18.下列物质的转变,不能一步实现的是( )
| A. | CO2→CO | B. | H2O2→H2 | C. | CaCO3→CO2 | D. | S→SO2 |

