题目内容
13g锌放入100g稀硫酸中,恰好完全反应(Zn+H2SO4=ZnSO4+H2↑).
求:这种稀硫酸中溶质质量分数.
求:这种稀硫酸中溶质质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:根据锌与硫酸反应的化学方程式,由13g锌的质量计算恰好完全反应时消耗稀硫酸中溶质的质量,然后分别利用溶液中溶质质量分数的计算公式,求出稀硫酸中溶质的质量分数.
解答:解:设稀硫酸中溶质的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
=
x=19.6g
稀硫酸中溶质质量分数=
×100%=19.6%;
答:这种稀硫酸中溶质质量分数为19.6%.
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
| 65 |
| 13g |
| 98 |
| x |
x=19.6g
稀硫酸中溶质质量分数=
| 19.6g |
| 100g |
答:这种稀硫酸中溶质质量分数为19.6%.
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用题,题型基础难度不大;

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
以下物质中,属于氧化物的是( )
| A、O2 |
| B、SO2 |
| C、KMnO4 |
| D、Ca(HCO3)2 |


 某同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静止一会,采用如图所示装置进行过滤.请问:
某同学将浑浊的湖水样品倒入烧杯中,先加入明矾粉末搅拌溶解,静止一会,采用如图所示装置进行过滤.请问: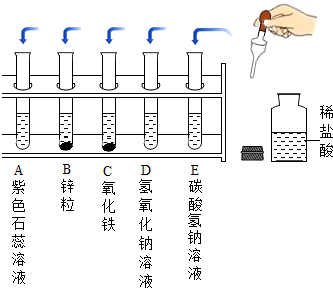 某化学实验小组探究稀盐酸的化学性质,取5支试管分别用A~E编号后,进行如图所示实验.请回答:
某化学实验小组探究稀盐酸的化学性质,取5支试管分别用A~E编号后,进行如图所示实验.请回答: