题目内容
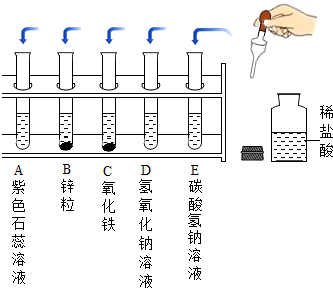 某化学实验小组探究稀盐酸的化学性质,取5支试管分别用A~E编号后,进行如图所示实验.请回答:
某化学实验小组探究稀盐酸的化学性质,取5支试管分别用A~E编号后,进行如图所示实验.请回答:(1)用pH试纸测得稀盐酸的pH=2,判断稀盐酸呈
(2)如右图实验中,溶液的颜色发生改变的试管是
(3)写出B、E两支试管中反应的化学方程式分别为:
B
(4)试管D中的反应是中和反应.请写出中和反应的1种用途:
考点:酸的化学性质,溶液的酸碱性与pH值的关系,反应类型的判定,书写化学方程式、文字表达式、电离方程式
专题:常见的酸 酸的通性
分析:(1)根据当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性,;当溶液的pH大于7时,呈碱性解答;
(2)根据酸能使紫色石蕊试液变红,稀盐酸和铁反应溶液变为浅绿色,稀盐酸和氧化铁反应,溶液变为黄色解答;
(3)根据盐酸和铁反应生成氯化铁和氢气,盐酸和碳酸氢钠反应生成氯化钠、二氧化碳和水解答;
(4)根据D中是氢氧化钠,氢氧化钠和稀盐酸反应生成氯化钠和水,属于中和反应解答,并说明用途.
(2)根据酸能使紫色石蕊试液变红,稀盐酸和铁反应溶液变为浅绿色,稀盐酸和氧化铁反应,溶液变为黄色解答;
(3)根据盐酸和铁反应生成氯化铁和氢气,盐酸和碳酸氢钠反应生成氯化钠、二氧化碳和水解答;
(4)根据D中是氢氧化钠,氢氧化钠和稀盐酸反应生成氯化钠和水,属于中和反应解答,并说明用途.
解答:解:
(1)用pH试纸测得稀盐酸的pH=2,当溶液的pH小于7时,呈酸性,判断稀盐酸呈酸性;
(2)酸能使紫色石蕊试液变红,稀盐酸和铁反应,因为生成氯化亚铁,亚铁离子为浅绿色,溶液变为浅绿色,稀盐酸和氧化铁反应,生成氯化铁,铁离子为黄色,故溶液变为黄色,溶液的颜色发生改变的试管是ABC;
(3)B为铁,稀盐酸和铁反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑,属于一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应,是置换反应;E是碳酸氢钠,稀盐酸和碳酸氢钠反应生成氯化钠、二氧化碳和水,反应的化学方程式为:HCl+NaHCO3=NaCl+CO2↑+H2O
(4)中和反应是酸与碱反应生成盐和水的反应,D中是氢氧化钠,氢氧化钠和稀盐酸反应生成氯化钠和水,属于中和反应,中和反应的用途是用熟石灰降低土壤酸性、用熟石灰处理硫酸厂排放的废水、用氢氧化铝治疗胃酸过多等.
答案:
(1)酸性
(2)ABC
(3)Fe+2HCl=FeCl2+H2↑ 置换 HCl+NaHCO3=NaCl+CO2↑+H2O
(4)用熟石灰降低土壤酸性
(1)用pH试纸测得稀盐酸的pH=2,当溶液的pH小于7时,呈酸性,判断稀盐酸呈酸性;
(2)酸能使紫色石蕊试液变红,稀盐酸和铁反应,因为生成氯化亚铁,亚铁离子为浅绿色,溶液变为浅绿色,稀盐酸和氧化铁反应,生成氯化铁,铁离子为黄色,故溶液变为黄色,溶液的颜色发生改变的试管是ABC;
(3)B为铁,稀盐酸和铁反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑,属于一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应,是置换反应;E是碳酸氢钠,稀盐酸和碳酸氢钠反应生成氯化钠、二氧化碳和水,反应的化学方程式为:HCl+NaHCO3=NaCl+CO2↑+H2O
(4)中和反应是酸与碱反应生成盐和水的反应,D中是氢氧化钠,氢氧化钠和稀盐酸反应生成氯化钠和水,属于中和反应,中和反应的用途是用熟石灰降低土壤酸性、用熟石灰处理硫酸厂排放的废水、用氢氧化铝治疗胃酸过多等.
答案:
(1)酸性
(2)ABC
(3)Fe+2HCl=FeCl2+H2↑ 置换 HCl+NaHCO3=NaCl+CO2↑+H2O
(4)用熟石灰降低土壤酸性
点评:本题主要探究了酸的有关性质,以及中和反应在日常生活的用途,有关实验方案的设计和对实验方案的评价是中考的热点之一.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现有两瓶失去标签的气体,其中一瓶是氧气,另一瓶是二氧化碳.下列实验操作不能鉴别出它们的是( )
| A、观察气体的颜色 |
| B、将带火星的木条伸入集气瓶中 |
| C、将集气瓶倒扣在水中 |
| D、向集气瓶中滴加澄清石灰水后振荡 |
 如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,B能用于灭火,“-”表示相连两物质之间能相互反应.
如图是某同学学习了氢氧化钠的化学性质后绘制的知识网络图,其中A、B、C分别表示不同类别的化合物,已知A是一种硫酸盐,其溶液呈蓝色,B能用于灭火,“-”表示相连两物质之间能相互反应.
 ,则X的值为
,则X的值为