题目内容
4.工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.以粗盐为原料的“氯碱工业”流程如图:
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途.下列关于氢氧化钠的描述中,错误的是C(填序号).
A.能去除油污,可做厨房清洁剂 B.易溶于水,溶解时放出大量的热
C.水溶液能使石蕊试液变红 D.可用作某些气体的干燥剂
(2)操作②的名称是过滤,操作④的名称是蒸发.
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之后(填“前”或“后”)加入.有同学提出用氢氧化钡溶液代替BaCl2溶液可达到同样的目的.
(4)电解饱和NaCl溶液的化学方程式是2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(5)该流程中可以循环利用的物质是NaCl.
分析 (1)A、根据氢氧化钠可以将油污分解转换进行分析;
B、根据氢氧化钠的化学性质进行分析;
C、根据酸碱指示剂遇到酸碱后的进行分析解答;
D、根据氢氧化钠的吸水性进行分析;
(2)根据经过操作②后分出了溶液和固体进行分析;
根据经过操作④后溶液由不饱和变成了饱和状态进行分析;
(3)根据氯化钡、碳酸钠所除去的离子分析;
根据除杂质的原则进行分析;
(4)根据氯化钠溶液在通电的条件下生成氢氧化钠、氢气和氯气进行分析;
(5)根据该反应的流程图进行分析.
解答 解:(1)A、氢氧化钠可以和油污反应生成硬脂酸钠而将油污溶解,故A正确,
B、氢氧化钠极易溶于水,并且放出大量的热,故B正确,
C、石蕊遇碱变蓝色,故C错误,
D、氢氧化钠具有吸水潮解的性质,所以可以干燥某些气体,故D正确,
故选:C;
(2)过滤是将固体和液体进行分离的一种操作,经过操作②后分出了溶液和固体,所以操作②的名称是:过滤;
经过作④后溶液由不饱和变成了饱和状态,说明水分减少了,所以操作④的名称是:蒸发;
(3)加入过量的氯化钡是为了除去硫酸钠,加入过量的碳酸钠是为了除去剩余的氯化钡和氯化钙,顺序加反后,剩余的氯化钡也就成了杂质;
氯化钡是为了除去硫酸根离子,加入氢氧化钡后钡离子可以将硫酸根离子沉淀,氢氧根离子能够被盐酸反应,不会引入新的杂质离子;
(4)饱和的氯化钠在通电的条件下生成氯化钠、氢气和氯气,化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(5)根据装置图可以看出,电解反应后的溶液中依然存在氯化钠,氯化钠蒸发变成饱和状态时又可以电解.
故答案为:(1)C;
(2)过滤,蒸发;
(3)后,氢氧化钡;
(4)2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(5)NaCl.
点评 本题主要考查了粗盐提纯时的物质的除杂和净化,在除杂质时不要引入新的杂质.

| A. | 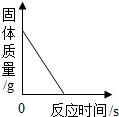 加热一定量高锰酸钾固体制取氧气 | |
| B. | 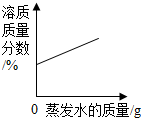 在恒温的条件下,将足量的氯化钠饱和溶液蒸发适量的水分 | |
| C. | 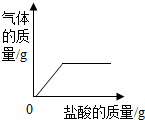 向露置在空气中部分变质的氢氧化钠溶液中逐滴加入稀盐酸 | |
| D. | 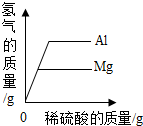 等质量的铝和镁,分别与足量、等溶质质量分数的稀硫酸反应 |
①H ②Fe2+ ③Cu ④P2O5 ⑤Fe3+⑥NaCl.
| A. | 能表示一个分子的是①④⑥ | |
| B. | ④中的数字“5”表示五氧化二磷中有5个氧原子 | |
| C. | 表示物质组成的化学式是③④⑥ | |
| D. | ②⑤的质子数相同,化学性质也相同 |
①FeTiO3+H2═Fe+TiO2+H2O;
②TiO2+2C+2Cl2═X+2CO;
③TiCl4+2Mg═2MgCl2+Ti
下列叙述不正确的是( )
| A. | 反应①中的H2被还原 | B. | 反应②Cl2中的“Cl”得到电子 | ||
| C. | 反应②中X为TiCl4 | D. | 反应③说明Mg的金属活动性比Ti强 |
 如图中A、B、C、D、E是初中化学常见的五种不同类别的物质,E是导致温室效应的一种气体,图中“-”表示 相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物及反应条件省略).
如图中A、B、C、D、E是初中化学常见的五种不同类别的物质,E是导致温室效应的一种气体,图中“-”表示 相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物及反应条件省略). 钠及其化合物是中学化学学习和研究的重要内容.
钠及其化合物是中学化学学习和研究的重要内容.