题目内容
14.人们可从铁钛矿(主要成分FeTiO3)制取金属钛(Ti),其在一定条件下的主要反应有:①FeTiO3+H2═Fe+TiO2+H2O;
②TiO2+2C+2Cl2═X+2CO;
③TiCl4+2Mg═2MgCl2+Ti
下列叙述不正确的是( )
| A. | 反应①中的H2被还原 | B. | 反应②Cl2中的“Cl”得到电子 | ||
| C. | 反应②中X为TiCl4 | D. | 反应③说明Mg的金属活动性比Ti强 |
分析 A.根据物质的得氧失氧情况来分析;
B.根据氯气单质由氯原子构成,反应后成为氯离子分析得失电子;
C.根据质量守恒定律来分析;
D.根据金属的活动性顺序来分析.
解答 解:A.反应①中的H2夺取FeTiO3中的氧被氧化成水,故错误;
B.反应②Cl2中的“Cl原子”得到电子成为氯离子,故正确;
C.由质量守恒定律可知,反应前后原子的种类与数目不变,②TiO2+2C+2Cl2═X+2CO,反应前有Ti、2C、2O和4Cl,反应后有2C、2O,则X中含有Ti、4Cl,X的化学式为TiCl4,故正确;
D.活泼的金属能将活泼型较弱的金属从其盐溶液中置换出来,由④可知,Mg的金属活动性比Ti强,故正确.
故选A.
点评 本题考查氧化反应、化合价、金属的活动性及原子与离子的关系,考查知识点全面,题目较难.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.践行绿色生活,创造可持续消费和生产的条件是“世界环境日”的永恒主题,下列生产或生活中的做法,符合这一主题的是( )
| A. | 提倡节日大量燃放烟花爆竹,增加喜庆气氛 | |
| B. | 为解决“白色污染”问题,应将废旧塑料袋焚烧处理 | |
| C. | 为提高农作物产量并减少污染,应合理使用农药和化肥 | |
| D. | 为了使食品保质期延长,我们在食品中加入大量防腐剂 |
2.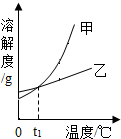 NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
 NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )| 温度/℃ | 20 | 30 | 50 | 60 | |
| 溶解度S/g | NH4Cl | 37.2 | 41.4 | 50.4 | 55.2 |
| KNO3 | 31.6 | 45.3 | 85.5 | 110 | |
| A. | 甲表示NH4Cl溶解度曲线 | |
| B. | t1应介于20℃~30℃ | |
| C. | 40℃时,给饱和溶液蒸发相同质量的水,析出晶体的质量:KNO3>NH4Cl | |
| D. | 50℃时,在50g水中分别加入30gKNO3、30gNH4Cl,得到的溶液质量分数都是37.3% |
19.如图为某反应的微观示意图,其中不同的球代表不同元索的原子.下列说法正确的是( )


| A. | 反应前后质量减少 | B. | 丙的化学式为C02 | ||
| C. | 该反应为置换反应 | D. | 甲物质用于灭火 |
6. 如图是某元素的原子结构示意圈.下列说法正确的是( )
如图是某元素的原子结构示意圈.下列说法正确的是( )
 如图是某元素的原子结构示意圈.下列说法正确的是( )
如图是某元素的原子结构示意圈.下列说法正确的是( )| A. | 该原子的原子序数是2 | B. | 该原子的核外电子数为l2 | ||
| C. | 该原子的质子数是8 | D. | 该原子带12个单位正电荷 |
3.下列变化属于化学变化的是( )
| A. | 粮食酿酒 | B. | 汽油挥发 | C. | 风力发电 | D. | 海水晒盐 |
4.实验室配制50g质量分数为15%的氯化钠溶液时,下列某操作对溶质质量分数没有影响的是( )
| A. | 称量氯化钠时,将砝码放在左盘(lg以下用游码) | |
| B. | 用仰视的方法量取42.5mL的蒸馏水 | |
| C. | 把配制好的溶液转移至试剂瓶时有少量溅出 | |
| D. | 把配制好的溶液转移至刚用蒸馏水洗涤过的试剂瓶 |
