题目内容
13. 钠及其化合物是中学化学学习和研究的重要内容.
钠及其化合物是中学化学学习和研究的重要内容.(1)如图1是钠的原子结构示意图,钠在反应中失电子后形成离子的符号是Na+.
(2)钠在氯气中燃烧生成氯化钠,化学方程式为2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl.
(3)配制一瓶符合如图2所示的氯化钠溶液,需氯化钠4.5g;小明同学配制的氯化钠溶液质量分数偏小了,请写出他操作中可能出现的错误(提示:1g以下用游码,至少答出两点).
(4)如何测定一瓶苏打水的酸碱度(写出实验操作步骤).
(5)小苏打受热分解生成碳酸钠、二氧化碳和水,化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(6)钛和钛合金性能优良,广泛用于航空、造船和化学工作中.工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛.若用该方法制取2.4kg钛,理论上需要钠的质量是多少?
分析 (1)根据钠原子的结构图进行分析;
(2)根据钠和氯气会生成氯化钠进行分析.
(3)根据溶质质量=溶液质量×溶质质量分数进行分析;根据俯视读数会使读出的数据大于实际数据进行分析;
(4)根据测定溶液pH的方法判断,使用pH试纸测定溶液pH,测定时,用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH;
(5)根据碳酸氢钠受热后的产物进行分析,
(6)根据在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛,然后结合题中的数据进行解答.
解答 解:
(1)钠元素的最外层有1个电子,容易失去电子,形成钠离子Na+;
(2)钠和氯气在点燃的条件下生成氯化钠,故答案为:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl;
(3)氯化钠的质量为:500mL×1g/mL×0.9%=4.5g,小明同学配制的氯化钠溶液质量分数偏小了,可能是称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯;
(4)测定溶液酸碱度的方法:用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(5)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(6)设理论上需要钠的质量是x
4Na+TiCl4$\frac{\underline{\;高温\;}}{\;}$Ti+4NaCl
92 48
x 2.4kg
$\frac{98}{x}=\frac{48}{2.4Kg}$
x=4.6kg
故答案为:
(1)Na+;
(2)2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl;
(3)4.5;称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯;
(4)用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(5)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(6)理论上需要钠的质量是4.6kg
点评 本题主要考查了钠的相关知识,难度不大,需要认真审题即可完成解答.掌握正确的实验操作是保证实验安全与成功的重要手段,了解实验的注意事项是解答本题的关键.

 如图为空气成分示意图(按体积计算),其中“a”代表的是( )
如图为空气成分示意图(按体积计算),其中“a”代表的是( )| A. | 氧气 | B. | 氮气 | C. | 其他成分 | D. | 稀有气体 |
| A. | 氢气和液氢都可作燃料--分子相同 | |
| B. | 氧气加压后变成液氧体积减小--分子变小 | |
| C. | 生铁和钢有相似的化学性质--由相同原子构成 | |
| D. | 酸和碱能发生中和反应--H+和OH一结合成H2O分子 |
| A. |  称取食盐 | B. |  CO2验满 | C. |  测溶液PH | D. |  取用块状固体 |
| A. | 提倡节日大量燃放烟花爆竹,增加喜庆气氛 | |
| B. | 为解决“白色污染”问题,应将废旧塑料袋焚烧处理 | |
| C. | 为提高农作物产量并减少污染,应合理使用农药和化肥 | |
| D. | 为了使食品保质期延长,我们在食品中加入大量防腐剂 |
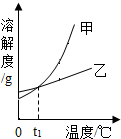 NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
NH4Cl和KNO3的溶解度表及溶解度曲线如下.下列说法正确的是( )| 温度/℃ | 20 | 30 | 50 | 60 | |
| 溶解度S/g | NH4Cl | 37.2 | 41.4 | 50.4 | 55.2 |
| KNO3 | 31.6 | 45.3 | 85.5 | 110 | |
| A. | 甲表示NH4Cl溶解度曲线 | |
| B. | t1应介于20℃~30℃ | |
| C. | 40℃时,给饱和溶液蒸发相同质量的水,析出晶体的质量:KNO3>NH4Cl | |
| D. | 50℃时,在50g水中分别加入30gKNO3、30gNH4Cl,得到的溶液质量分数都是37.3% |
| A. | 粮食酿酒 | B. | 汽油挥发 | C. | 风力发电 | D. | 海水晒盐 |

