题目内容
一定条件下,在体积为3 L的密闭容器中化学反应CO(g)+2H2(g)CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=________;根据下图,升高温度,K值将______(填“增大”、“减小”或“不变”)。
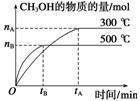
(2)500 ℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB,tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是______(填字母)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(4)300 ℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是____(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时c(H2)/c(CH3OH)减小
答案 (1) 减小
(2) mol·L-1·min-1 (3)cd (4)cd
解析 (1)根据所给图像判断,500 ℃时CH3OH的量比300 ℃时CH3OH的量少,说明升高温度平衡逆向移动,K值减小。
(2)由于v(CH3OH)∶v(H2)=1∶2,因此可先求出v(CH3OH),再推算出v(H2)。
(3)a项中均为同一方向的反应速率,故不可判断;b项中由于气体的总质量为定值,且容器的体积保持不变,故密度一直不变,不可判断。
(4)体积压缩后,v正、v逆均增大,但v正增加的比v逆多,平衡右移,CH3OH的物质的量增加;由于V减小,各物质的物质的量浓度均增加,但c(CH3OH)比c(H2)增大的多,所以c(H2)/c(CH3OH)减小。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
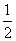 O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1 前的一片树木砍掉。
前的一片树木砍掉。 一种分类标准进行分类:
一种分类标准进行分类: ( )。
( )。