题目内容
16.为了测定某陨石中铁的含量,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反应后用天平称量,(杂质不与稀硫酸反应产生气体)几次试验数据如下,请回答下列问题并计算:| 试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
| 所取样品的质量/g | 50.0 | 50.0 | 50.0 | 50.0 |
| 加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
| 生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
(2)50.0g样品与足量稀硫酸反应最多能生成气体0.5g.
(3)计算陨石中铁的质量分数(写出具体计算过程).
分析 铁和稀硫酸反应生成硫酸亚铁和氢气,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)在第1次实验结束后,反应物硫酸完全反应完了.
故填:硫酸.
(2)50.0g样品与足量稀硫酸反应最多能生成气体0.5g.
故填:0.5.
(3)设铁的质量为x,
Fe+H2SO4═FeSO4+H2↑,
56 2
x 0.5g
$\frac{56}{x}$=$\frac{2}{0.5g}$,
x=14g,
陨石中铁的质量分数为:$\frac{14g}{50.0g}$×100%=28%,
答:陨石中铁的质量分数为28%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
11.下列对消化系统的相关知识叙述不正确的是( )
| A. | 蛋白质在胃液作用下进行初步的消化,进入小肠后被消化液充分分解成氨基酸 | |
| B. | 淀粉在唾液淀粉酶作用下分解成葡萄糖,在小肠处被吸收 | |
| C. | 胆汁虽不含消化酶,但能促进脂肪的消化 | |
| D. | 水、无机盐、维生素不经过消化,在消化道内可以直接被吸收 |
8.软锰矿的主要成分是MnO2,还含有少量重金属化合物等杂质.黄铁矿的 主要成分是FeS2,还含有硅、铝的氧化物等杂质.工业上采用同槽酸浸工艺制备碳酸锰并回收硫酸铵,其主要流程如下:
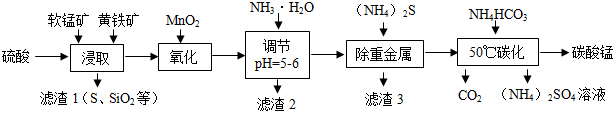
资料:Ⅰ.“氧化”时发生反应:MnO2+2FeSO4+2H2SO4=Fe2(SO4)3+MnSO4+2H2O
Ⅱ.部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见表:
请回答:
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度;②搅拌;③加入足量硫酸;
(2)“滤渣2”中主要成分的化学式为Al(OH)3、Fe(OH)3;
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是能够防止带入钠离子;
(4)“50℃碳化”得到碳酸锰,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑;
(5 )生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加入氯化钡溶液,不产生沉淀.

资料:Ⅰ.“氧化”时发生反应:MnO2+2FeSO4+2H2SO4=Fe2(SO4)3+MnSO4+2H2O
Ⅱ.部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)为了提高锰元素的浸出率,在“浸取”时可采取的措施有:①适当升高温度;②搅拌;③加入足量硫酸;
(2)“滤渣2”中主要成分的化学式为Al(OH)3、Fe(OH)3;
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是能够防止带入钠离子;
(4)“50℃碳化”得到碳酸锰,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+H2O+CO2↑;
(5 )生成的碳酸锰产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加入氯化钡溶液,不产生沉淀.

 (1)如图是A、B、C三种物质的溶解度曲线,如果t3℃时,将等质量的三种物质的饱和溶液温度冷却到t1℃,析出晶体最多的是B,一定没有晶体析出的是C.
(1)如图是A、B、C三种物质的溶解度曲线,如果t3℃时,将等质量的三种物质的饱和溶液温度冷却到t1℃,析出晶体最多的是B,一定没有晶体析出的是C. 镁是一种活泼金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应.为测定镁铝合金(不含其他元素)中镁的质量分数,称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧.下列关于该实验的说法正确的是( )
镁是一种活泼金属,除了能与氧气反应,还可以与氮气、二氧化碳等反应.为测定镁铝合金(不含其他元素)中镁的质量分数,称量ag镁铝合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧.下列关于该实验的说法正确的是( ) 我们每天摄入的食物不仅要保证一定的数量,还要注意合理搭配,以保证各种营养素的均衡摄入.“营养平衡膳食宝塔”为我们提供了合理选择食物的指南.请回答问题:
我们每天摄入的食物不仅要保证一定的数量,还要注意合理搭配,以保证各种营养素的均衡摄入.“营养平衡膳食宝塔”为我们提供了合理选择食物的指南.请回答问题: