题目内容
18.王同学以不同的化学思维方式或者规律给下列化学反应的类型进行分类,你认为分类合理的一组是( )①CaO+H2O=Ca(OH)2;
②Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;
③Ba(OH)2+2HCl=BaCl2+2H2O;
④Fe+H2SO4=FeSO4+H2↑;
⑤2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO.
| A. | 属于有热量放出的反应的是②③ | B. | 属于化合反应的是①② | ||
| C. | 属于有化合价变化的反应是④⑤ | D. | 属于复分解反应的是③④ |
分析 化合反应是指由两种或两种以上物质反应生成一种物质的反应.分解反应是指由一种物质生成两种或两种以上物质的反应.置换反应是指由一种单质和一种化合物反应,生成另外一种单质和一种化合物的反应.复分解反应是指由两种化合物反应,生成另外两种化合物的反应.
①是两种物质反应生成一种物质的反应属于化合反应;
②是由一种物质生成两种或两种物质的反应属于分解反应;且反应需加热才能进行,反应吸热;
③是由两种化合物反应,生成另外两种化合物的反应属于复分解反应,反应放热;
④是由一种单质和一种化合物反应,生成另外一种单质和一种化合物的反应属于置换反应;锌元素、氢元素反应前后化合价有变化;
⑤是两种物质反应生成一种物质的反应属于化合反应;镁元素、氧元素反应前后化合价有变化;
解答 解:A、②反应需加热才能进行,反应吸热,故错;
B、②属于分解反应,故错;
C、④铁元素、氢元素反应前后化合价有变化,⑤镁元素、氧元素反应前后化合价有变化.故对;
D、④属于置换反应,故错.
故选:C.
点评 解答本题要充分理解反应类型的分类方法方面的知识,只有这样才能对各种反应类型做出正确的判断.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
13.下列实验操作正确的是( )
| A. |  读取液体体积 | B. |  液体的倾倒 | C. |  液体的加热 | D. |  稀释浓硫酸 |
10.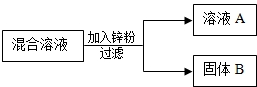 某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了右图实验,对固体B的成分进行了分析和实验探究.
某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了右图实验,对固体B的成分进行了分析和实验探究.
【提出问题】固体B中的成分可能有哪些?
【作出猜想】甲同学:只有Ag
乙同学:Zn、Ag
丙同学:Cu、Ag
请写出你的一种猜想(1)Ag、Cu、Zn
【表达交流】写出甲同学猜想的理由(2)当锌恰好与AgNO3反应时,溶液中的溶质是:Zn(NO3)2、Cu(NO3)2或当AgNO3有剩余时,溶液中的溶质是:Zn(NO3)2、AgNO3、Cu(NO3)2,固体为:只有Ag;
【反思评价】请你评价乙同学的猜想(3)不合理,Zn应先与AgNO3反应后与Cu(NO3)2反应
【实验探究】想证明自己的猜想正确
在得出固体B的成分后,也确定了液体A的成分,液体A中含有的物质有(化学式)(6)Zn(NO3)2.
 某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了右图实验,对固体B的成分进行了分析和实验探究.
某化学小组用一定量AgNO3和Cu(NO3)2混合溶液进行了右图实验,对固体B的成分进行了分析和实验探究.【提出问题】固体B中的成分可能有哪些?
【作出猜想】甲同学:只有Ag
乙同学:Zn、Ag
丙同学:Cu、Ag
请写出你的一种猜想(1)Ag、Cu、Zn
【表达交流】写出甲同学猜想的理由(2)当锌恰好与AgNO3反应时,溶液中的溶质是:Zn(NO3)2、Cu(NO3)2或当AgNO3有剩余时,溶液中的溶质是:Zn(NO3)2、AgNO3、Cu(NO3)2,固体为:只有Ag;
【反思评价】请你评价乙同学的猜想(3)不合理,Zn应先与AgNO3反应后与Cu(NO3)2反应
【实验探究】想证明自己的猜想正确
| 实验步骤 | 现象 | 由此确定固体B的成分写出反应的化学方程式 |
| 取少量固体B,滴加(4)稀盐酸 | 有气泡产生 | (5)Zn+2HCl=ZnCl2+H2↑ |
7.已知某种铸造钢轨的金属粉末原料中可能含有铁、锰、铜三种金属中的两种或三种,化学小组的同学对该粉末进行探究.
(1)提出猜想:
猜想一:该粉末由铜、锰组成; 猜想二:该粉末由铁、锰组成;
猜想三:该粉末由铁、锰、铜组成;猜想四:该粉末由铁和铜组成.
(2)查阅资料:金属锰不能被磁铁所吸引,锰和FeSO 4溶液可以发生置换反应,Mn元素在生成物中显+2价,生成物的溶液为浅粉色.
(3)进行实验:
(4)初步结论:猜想三成立;实验①中发生反应的化学方程式为Fe+2HCl=FeCl2+H2↑,Mn+2HCl=MnCl2+H2↑.
(5)数据处理:试计算粉末原料中任意一种金属所占的质量分数(用金属名称和百分数表示,结果保留一位小数)锰20%、铁79.6%、铜0.4%.
(1)提出猜想:
猜想一:该粉末由铜、锰组成; 猜想二:该粉末由铁、锰组成;
猜想三:该粉末由铁、锰、铜组成;猜想四:该粉末由铁和铜组成.
(2)查阅资料:金属锰不能被磁铁所吸引,锰和FeSO 4溶液可以发生置换反应,Mn元素在生成物中显+2价,生成物的溶液为浅粉色.
(3)进行实验:
| 实验目的 | 实验操作 | 实验现象 |
| ①证明粉末中是否含有铜 | 取一个小烧杯,加入适量的粉末,再向其中加入足量的稀盐酸或稀硫酸. | 有少量红色粉末不能溶解. |
| ②证明粉末中是否含有锰 | 取5.5克粉末放入烧杯,再向其中加入适量的硫酸亚铁溶液,反应完全后过滤、干燥,称量固体为5.52克. | 绿色溶液变为浅粉色. |
| ③证明粉末中是否含有铁 | 另取5.5克粉末,用磁铁充分吸引(用物理方法), 称量剩余金属粉末为1.12克. | 有大量黑色粉末被磁铁吸引. |
(5)数据处理:试计算粉末原料中任意一种金属所占的质量分数(用金属名称和百分数表示,结果保留一位小数)锰20%、铁79.6%、铜0.4%.


 如图所示是木炭还原氧化铜的实验,写出该反应的化学方程式:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2 ↑.实验完毕后,发现试管内仍有黑色固体物质存在,其中网罩的作用是提高温度.澄清石灰水的作用是验证反应是否产生二氧化碳.
如图所示是木炭还原氧化铜的实验,写出该反应的化学方程式:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2 ↑.实验完毕后,发现试管内仍有黑色固体物质存在,其中网罩的作用是提高温度.澄清石灰水的作用是验证反应是否产生二氧化碳.