题目内容
12.如图装置用于制取某些气体.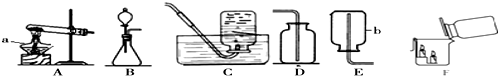
(1)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,选用的发生装置是B.检验收集到的气体是否是二氧化碳的方法是把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳.
如图 F 所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上 依次熄灭,说明二氧化碳具有的性质是既不能燃烧也不能支持燃烧,密度比空气大.
(2)若用KMnO4制取氧气,反应的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,不能选用的收集装置是E(填序号).
(3)虽然常温常压下乙烯(C2H4)不与空气反应,但因密度很接近空气而不用排空气法收集.若用排空气法收集乙烯,将得到气体的质量不纯;排水法收集乙烯时,待导气管口连续稳定地冒出气泡才开始收集,原因是排出装置内的空气,避免收集的乙炔不纯.
(4)实验室收集某气体只能用装置E,由此说明该气体具有的物理性质是易溶于水,密度比空气小.
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳.如图F所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上 依次熄灭,说明二氧化碳具有的性质是把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;虽然常温常压下乙烯(C2H4)不与空气反应,但因密度很接近空气而不用排空气法收集.若用排空气法收集乙烯,将得到气体的质量不纯;排水法收集乙烯时,待导气管口连续稳定地冒出气泡才开始收集,原因是:排出装置内的空气,避免收集的乙炔不纯.实验室收集某气体只能用装置E,由此说明该气体具有的物理性质是:易溶于水,密度比空气小.
解答 解:(1)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;如图F所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上 依次熄灭,说明二氧化碳具有的性质是把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;B;把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;CE;
(3)虽然常温常压下乙烯(C2H4)不与空气反应,但因密度很接近空气而不用排空气法收集.若用排空气法收集乙烯,将得到气体的质量不纯;排水法收集乙烯时,待导气管口连续稳定地冒出气泡才开始收集,原因是:排出装置内的空气,避免收集的乙炔不纯;故答案为:得到气体的质量不纯;排出装置内的空气,避免收集的乙炔不纯;
(4)实验室收集某气体只能用装置E,由此说明该气体具有的物理性质是:易溶于水,密度比空气小;故答案为:易溶于水,密度比空气小;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的检验和性质等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | H2O$\frac{\underline{\;点燃\;}}{\;}$O2+2H2 | B. | 4Fe+3O2=2Fe2O3 | ||
| C. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2 | D. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO |
| 实验方案 | 使用的试剂 | 判断的方法 |
| A | 铁粉 | 如果有气泡产生,表明盐酸已经过量 |
| B | pH试纸 | 如果pH<7,表明盐酸已经过量 |
| C | 硝酸银溶液 | 如果有白色沉淀产生,表明盐酸已经过量 |
| D | 紫色石蕊试剂 | 如果溶液变成红色,表明盐酸已经过量 |
| A. | A | B. | B | C. | C | D. | D |
| 浓硫酸(H2SO4)500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封储藏 | |
(2)欲配制1000克质量分数为19.6%的稀硫酸,需要多少克这种浓硫酸?
| A. | 金属原子 | B. | 非金属原子 | C. | 稀有气体原子 | D. | +2价阳离子 |