题目内容
4.海水是一种重要的自然资源.以下是对海水资源的部分利用.(1)从海水中获取淡水.常用的操作方法是蒸馏.
(2)从海水中获得氯化钠.将海水进行蒸发可得到粗盐;粗盐中含有泥沙、硫酸镁、氯化钙等杂质.将粗盐溶于水,然后再进行如下操作即可得到较纯的氯化钠:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液.正确的操作顺序是①②⑤④③.(用序号填一种合理组合).
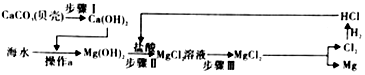
(3)从海水中得到金属镁.如图是从海水中提取镁的简单流程.

上述过程中,沉淀B与试剂C发生的是中和反应,发生的反应化学方程式为Mg(OH)2+2HCl═MgCl2+2H2O,海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:通过步骤①、②得到的氯化镁溶液中氯化镁的质量分数比海水中氯化镁的质量分数大.
(4)海水“制碱”.如图是海水“制碱”的部分简单流程.
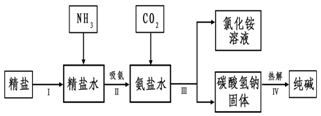
吸氨,就是NH3气溶于水得到氨盐水,该溶液的pH大于 7(填写“大于”“小于”或“等于”)
工业生产纯碱的流程中,碳酸化时析出碳酸氢钠而没有析出碳酸钠的原因是相同条件下,碳酸钠的溶解度大于碳酸氢钠的溶解度.
分析 (1)从海水中获取淡水.常用的操作方法是蒸馏;
(2)从海水中获得氯化钠.将海水进行蒸发可得到粗盐;
正确的操作顺序是过滤除去泥沙、加过量的NaOH溶液除去硫酸镁、加过量的BaCl2溶液除去反应生成的硫酸钠、加过量的Na2CO3溶液除去氯化钙和过量的氯化钡,加入适量稀盐酸除去过量的氢氧化钠和碳酸钠;
(3)上述过程中,沉淀B是氢氧化镁,试剂C是稀盐酸,氢氧化镁和稀盐酸反应生成氯化镁和水;
(4)氨盐水显碱性,pH大于7;相同条件下,物质的溶解度越小,越容易从溶液中析出.
解答 解:(1)从海水中获取淡水.常用的操作方法是蒸馏.
故填:蒸馏.
(2)从海水中获得氯化钠.将海水进行蒸发可得到粗盐;
正确的操作顺序是过滤除去泥沙、加过量的NaOH溶液除去硫酸镁、加过量的BaCl2溶液除去反应生成的硫酸钠、加过量的Na2CO3溶液除去氯化钙和过量的氯化钡,加入适量稀盐酸除去过量的氢氧化钠和碳酸钠.
故填:蒸发;①②⑤④③.
(3)上述过程中,沉淀B是氢氧化镁,试剂C是稀盐酸,氢氧化镁和稀盐酸反应生成氯化镁和水,属于中和反应,发生的反应化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O;
海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液的不同之处在于:通过步骤①、②得到的氯化镁溶液中氯化镁的质量分数比海水中氯化镁的质量分数大.
故填:Mg(OH)2+2HCl═MgCl2+2H2O;通过步骤①、②得到的氯化镁溶液中氯化镁的质量分数比海水中氯化镁的质量分数大.
(4)吸氨,就是NH3气溶于水得到氨盐水,氨盐水显碱性,溶液的pH大于7;
工业生产纯碱的流程中,碳酸化时析出碳酸氢钠而没有析出碳酸钠的原因是相同条件下,碳酸钠的溶解度大于碳酸氢钠的溶解度.
故填:大于;相同条件下,碳酸钠的溶解度大于碳酸氢钠的溶解度.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 二氧化碳可用作气体肥料 | |
| B. | 一氧化碳、二氧化碳都能还原氧化铁 | |
| C. | 木炭的吸附作用比活性炭强 | |
| D. | 一氧化碳是形成酸雨的罪魁祸首 |
| A. | 点燃某可燃物,在火焰上罩一个冷而干燥的烧杯,烧杯的内壁有水雾出现,则可燃物一定是H2或含有H2 | |
| B. | 某混合气体能使灼热的氧化铜变成红色固体,且导出后气体能使澄清石灰水变浑浊,证明原气体中一定含有一氧化碳 | |
| C. | 实验室不用稀硫酸和石灰石制取二氧化碳的原因是,两者无法反应 | |
| D. | 实验室用大理石与盐酸反应制取的CO2通入澄清石灰水无沉淀生成可能是因为盐酸太浓 |
| A. | ①②④③ | B. | ①④②③ | C. | ④①②③ | D. | ②③①④ |