题目内容
11.某同学利用图甲所示实验装置来测定铝元素的相对原子质量.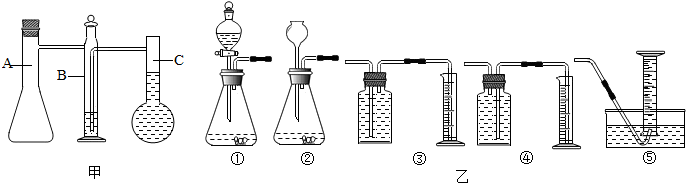
(1)图中仪器C的瓶颈上标有刻度.将一定质量的铝片和足量稀硫酸在仪器A中完全反应,产生的H2把仪器B中水压入C中,通过收集相关实验数据可计算出铝元素的相对原子质量.这里C装置的作用是测量反应生成氢气的体积 .再通过查得H2的密度,计算出产生H2的质量.
(2)该同学根据上述实验器材和实验方法测出铝的相对原子质量为27.22,而且前国际公认的铝元素的相对原子质量为26.98,可能引起该同学实验误差的原因是①②③.
①铝片中含有与硫酸不反应的杂质 ②没有除去铝片表面的氧化铝
③铝片中含有杂质镁
(3)利用实验室常用的仪器,也可组装一套与该同学具有相同原理的实验装置.你认为应选用图乙装置中的①④.
分析 (1)图中仪器C的瓶颈上标有刻度,根据进入C装置中的水的体积可以判断反应生成氢气的体积;
(2)计算铝的相对原子质量时,铝的相对原子质量和铝的质量成正比,和氢气的质量成反比;
(3)图乙装置中,①装置相当于A装置,④装置相当于B、C装置.
解答 解:(1)这里C装置的作用是测量反应生成氢气的体积,再通过查得H2的密度,计算出产生H2的质量.
故填:测量反应生成氢气的体积;质量.
(2)设铝的相对原子质量为x,反应的铝的质量为m,氢气密度为 ρ,体积为V,
2Al+3H2SO4═Al2(SO4)3+3H2↑,
2x 6
m ρV
$\frac{2x}{m}$=$\frac{6}{ρV}$,
x=$\frac{6m}{ρV}$,
①铝片中含有与硫酸不反应的杂质时,会导致产生氢气体积偏小,从而导致计算出的铝相对原子质量偏大;
②没有除去铝片表面的氧化铝时,会导致产生氢气体积偏小,从而导致计算出的铝相对原子质量偏大;
③由于相同质量的镁、铝和稀硫酸完全反应时,铝和稀硫酸反应生成的氢气体积大,因此铝片中含有杂质镁时,会导致产生氢气体积偏小,从而导致计算出的铝相对原子质量偏大.
故填:①②③.
(3)图乙装置中,①装置相当于A装置,④装置相当于B、C装置.
故填:①④.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
6.下列实验方案能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验氯化钙溶液中含有稀盐酸 | 取样,加入适量的碳酸钙 |
| B | 区分氢氧化钠溶液和氢氧气化钙溶液 | 取样,加入无色酚酞溶液 |
| C | 区分三种固体:NH4NO3、NaOH和KNO3 | 取样,加适量水 |
| D | 证明氢氧化钠已部分变质 | 取样,加入少量的稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
16.如图实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  量筒量取液体 | ||
| C. |  将固体药品装入试管中 | D. |  称取一定质量的氢氧化钠 |
1.通常所说的燃烧、爆炸和缓慢氧化之间的相同之处是( )
| A. | 都属于氧化反应 | B. | 都有发光、发热现象 | ||
| C. | 都是剧烈的化学反应 | D. | 可燃物都要达到着火点 |
 实验室有如图所示装置,回答下列问题:
实验室有如图所示装置,回答下列问题: