题目内容
13.某研究小组按如图所示流程进行“燃煤烟气的脱硫研究”.实验中,SO2和O2混合气体连续通入,水和铁在起始时一次性加入,反应液多次循环.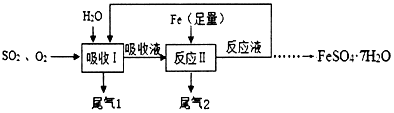
(1)I中反应的化学方程式是2SO2+2H2O+O2═2X,则X的化学式是H2SO4.I中用水吸收时为了提高SO2和O2的吸收效率,从影响气体溶解度的因素考虑应控制温度不宜过高(填“高”或“低”).
(2)反应Ⅱ中发生反应的化学方程式是Fe+H2SO4=FeSO4+H2↑.
(3)为确保反应液的循环吸收效果,吸收液与铁的反应需控制在40℃左右进行,在此条件下欲加快该反应速率宜采取的措施有使用铁粉(或搅拌或使用催化剂)(只要答一点).随着反应液循环流入I中,吸收液中X的生成速率明显加快,其原因可能是生成的FeSO4(或Fe2+)起催化作用.
(4)经过多次循环以后导出反应液,经降温结晶、过滤、洗涤和干燥,制得FeSO4•7H2O晶体.它在医疗上常用于治疗D(选填字母)
A、甲状腺肿大 B、佝偻病 C、龋齿 D、贫血症.
分析 (1)根据质量守恒定律,化学反应前后各原子的种类和数目不变,反应前各原子的数目之和等于反应后各原子的数目之和,据此可推断X的化学式,根据温度对气体溶解度的影响来分析;
(2)根据铁与硫酸反应生成硫酸亚铁和氢气写出化学方程式;
(3)根据加快化学反应速率的措施来分析;
(4)根据分离混合物的方法以及贫血可能缺少铁元素造成的来解答.
解答 解:(1)反应前S:2,O:8,H:4,反应后一个X分子的组成为2个氢原子、1个硫原子、4个氧原子,故化学式为:H2SO4;温度越高,气体的溶解度越小,所以I中用水吸收时为了提高SO2和O2的吸收效率,温度不宜过高;故填:H2SO4;高;
(2)铁与硫酸反应生成硫酸亚铁和氢气的写出化学方程式为:Fe+H2SO4=FeSO4+H2↑;故填:Fe+H2SO4=FeSO4+H2↑;
(3)为确保反应液的循环吸收效果,吸收液与铁的反应需控制在40℃左右进行,在此条件下可以使用铁粉(或搅拌或使用催化剂)来加快该反应速率;吸收液中X的生成速率明显加快,其原因可能是生成的硫酸亚铁(或Fe2+)对亚硫酸氧化生成硫酸的反应起催化作用,故填:使用铁粉(或搅拌或使用催化剂);生成的FeSO4(或Fe2+)起催化作用;
(4)从溶液中分离出晶体,采用过滤的方法,FeSO4•7H2O中含铁元素,可治疗贫血症,而A与碘元素有关,B与钙元素有关,C与氟元素有关,故答案为:过滤;D.
点评 本题为信息题,考查学生分析与应用知识的能力,涉及影响反应速率的因素、质量守恒定律、化学与生活等,综合性较强,题目难度不大.

练习册系列答案
相关题目
1.下列实验操作中正确的是( )
| A. | 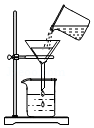 | B. | 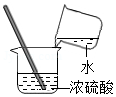 | C. | 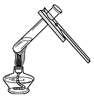 | D. | 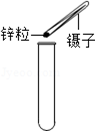 |
5.先取甲、乙、丙、丁四种金属粉末,分别投入相同浓度的稀盐酸中,只有甲、乙能产生气体,且甲的盐溶液不能用乙制成的容器盛放;再取一小块丁投入丙的硝酸盐溶液中,丁的表面有丙析出.则甲、乙、丙、丁四种金属的活动性顺序为( )
| A. | 甲>乙>丙>丁 | B. | 乙>甲>丙>丁 | C. | 丁>丙>乙>甲 | D. | 乙>甲>丁>丙 |
3.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙等杂质,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液.以下顺序正确的( )
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ⑤④②①③ | D. | ⑤②④③① |
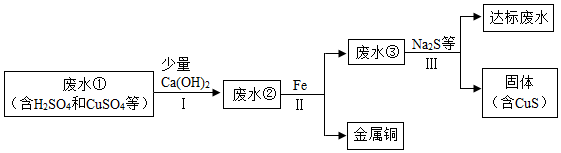

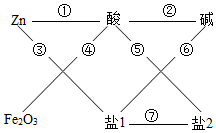 稀硫酸(H2SO4)、氢氧化钠(NaOH)、氯化钡(BaCl2)、硫酸铜(CuSO4)等溶液可参与如图所示的七大化学变化
稀硫酸(H2SO4)、氢氧化钠(NaOH)、氯化钡(BaCl2)、硫酸铜(CuSO4)等溶液可参与如图所示的七大化学变化 水是重要资源.
水是重要资源.