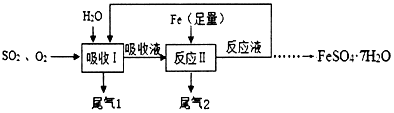
题目内容
3.矿山废水中含有大量的H2SO4和CuSO4,直接排放会影响水体酸碱性,并造成重金属污染.通过处理可以回收金属铜,并使废水pH和重金属含量达到排放标准.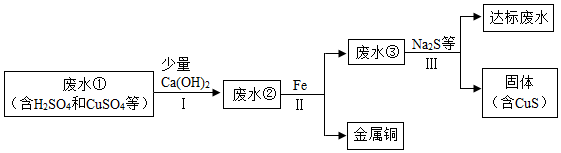
已知:步骤无蓝色沉淀生成.
(1)步骤Ⅱ和步骤Ⅲ都需进行的操作是过滤.
(2)步骤Ⅱ得到金属铜的反应的化学方程式为Fe+CuSO4=Cu+FeSO4.
(3)加入Ca(OH)2可以降低铁屑的消耗量,原因是Ca(OH)2会与废水中的硫酸发生反应,Ca(OH)2+H2SO4=CaSO4+2H2O;消耗了废水中的硫酸,减少了铁屑与硫酸的反应,化学方程式为:Fe+H2SO4=FeSO4+H2↑.(请用文字并结合化学方程式解释).
(4)步骤Ⅲ需加入Na2S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中含有CuSO4(或Cu2+).
分析 (1)过滤可以将固体和液体分开;
(2)由于金属活动性铁>铜,废水中加入铁,将铜置换出来;
(3)加入Ca(OH)2优先与硫酸反应,降低铁屑的消耗量;
(4)根据步骤Ⅲ加入Na2S后产生CuS分析.
解答 解:(1)步骤Ⅱ和步骤Ⅲ都将固体和液体分离,所以操作为过滤;故填:过滤;
(2)铁与硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;故填:Fe+CuSO4=Cu+FeSO4;
(3)加入Ca(OH)2优先与硫酸反应,消耗了废水中的硫酸,减少了铁屑与硫酸的反应,降低铁屑的消耗量;氢氧化钙与硫酸反应生成硫酸钙和水,化学方程式为:Ca(OH)2+H2SO4=CaSO4+2H2O,铁与硫酸反应生成硫酸亚铁和氢气;化学方程式为:Fe+H2SO4=FeSO4+H2↑;
故填:Ca(OH)2会与废水中的硫酸发生反应,Ca(OH)2+H2SO4=CaSO4+2H2O;消耗了废水中的硫酸,减少了铁屑与硫酸的反应,化学方程式为:Fe+H2SO4=FeSO4+H2↑;
(4)由于步骤Ⅲ加入Na2S后产生CuS,说明原废水③中含有CuSO4(或Cu2+),故填:CuSO4(或Cu2+).
点评 对于流程图的题目关健是看明白流程图中各物质的转化关系,注意过量物质的去向,如何除去过量物质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列关于分子、原子、离子的说法正确的是( )
| A. | 分子、原子、离子都是构成物质的微粒 | |
| B. | 分子比原子大 | |
| C. | 分子可以再分,而原子不能再分 | |
| D. | 离子就是带电的原子 |
18.如表列出了除去物质中所含少量杂质的方法,其中错误的是( )
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | CO | 点燃 |
| B | MnO2粉 | C粉 | 在空气中充分灼烧 |
| C | FeSO4溶液 | CuSO4溶液 | 加入足量的铁粉,过滤 |
| D | NaCl固体 | 泥沙 | 溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |




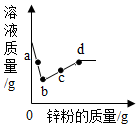 向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请分析a点时溶液中有哪些溶质?c点时过滤能得到哪些固体?b~d段溶液质量增加的原因是什么?
向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请分析a点时溶液中有哪些溶质?c点时过滤能得到哪些固体?b~d段溶液质量增加的原因是什么?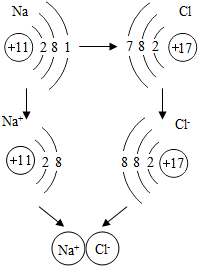 如图是金属钠与氯气反应生成氯化钠的微观示意图,根据图示回答下列问题.
如图是金属钠与氯气反应生成氯化钠的微观示意图,根据图示回答下列问题.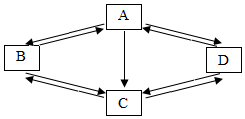 已知A、B、C、D是初中化学中常见的物质.它们之间的部分转化关系如图所示(图中反应条件及部分反应物、生成物已省略).A是一种温室效应的主要气体,B是单质.D在常温下不稳定易分解.
已知A、B、C、D是初中化学中常见的物质.它们之间的部分转化关系如图所示(图中反应条件及部分反应物、生成物已省略).A是一种温室效应的主要气体,B是单质.D在常温下不稳定易分解.