题目内容
13.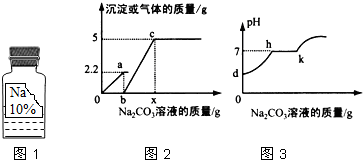 实验室有一瓶保管不当的试剂(如图1),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:
实验室有一瓶保管不当的试剂(如图1),其残缺的标签中只剩下“Na”和“10%”字样.已知它是无色液体,是初中化学常用的试剂.小强和小华同学很感兴趣,决定对其成分进行探究:【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是A;
【得出结论】;
【作出猜想】;
【设计并实验】
(1);
(2),;
【实验反思】
(3)CaCl2和HCl;
(4)h-k;
(5)53,106.
A、酸 B、碱 C、盐
【查阅资料】
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
Ⅱ.Na2CO3和NaHCO3溶液都呈碱性
Ⅲ.测定室温(20℃)时,四种物质的溶解度的数据如下:
| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度/g | 36 | 109 | 215 | 9.6 |
【作出猜想①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl.
【设计并实验】
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得PH>7,这瓶试剂不可能是NaCl(写化学式)
(2)小强为了检验给该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验:
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中,滴加氢氧化钙溶液 | 白色浑浊 | 猜想②正确 相关的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
小华同学用上述溶液对实验室制取CO2气体的废液进行后续探究,他向100克的废液中逐滴加入上述Na2CO3溶液.实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图2所示,加入Na2CO3溶液的质量与溶液的PH变化关系如图2所示
(3)小华同学所取废液中的溶质含CaCl2和HCl
(4)图2中b→c段反应过程中溶液的PH变化情况可用图3中h-k段表示
(5)图2中b和x的值分别为53克和106克.
分析 【交流讨论】根据物质的性质进行分析,含有金属元素的物质不可能是酸;
【得出结论】根据物质的溶解度可以计算出所形成的溶液的溶质质量分数解答;【作出猜想】根据题中信息解答;
【设计并实验】碱性溶液的pH大于7,碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,据此分析解答即可.
【实验反思】根据加入的碳酸钠先与盐酸反应,把盐酸消耗完了,才开始与氯化钙反应,开始生成沉淀,最后到达最高点说明已经反应完了进行解答.
解答 解:
【交流讨论】受损标签中含有钠元素,酸中不含有金属元素,故不可能是酸,故填:A;
【得出结论】根据20℃时各物质的溶解度,可以计算出其饱和溶液的溶质质量分数,
NaCl:$\frac{36g}{136g}$×100%≈24.5%;
NaOH$\frac{109g}{209g}$×100%≈52.2%;
Na2CO3:$\frac{215g}{315g}$×100%≈68.3%;
NaHCO3:$\frac{9.6g}{109.6g}$×100%≈8.8%;
标签上的溶质质量分数是10%,故不可能是碳酸氢钠,故填:NaHCO3;
【作出猜想】该物质可能是氢氧化钠溶液、碳酸钠溶液或氯化钠溶液,故填:NaOH;
【设计并实验】
(1)溶液的pH大于7,说明溶液呈碱性,而氯化钠的溶液呈中性,故不可能是氯化钠溶液,故填:NaCl;
(2)若猜想②正确,则碳酸钠能与氢氧化钙反应生成碳酸钙白色沉淀,故填:有白色沉淀生成,Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
【实验反思】
(3)由图2可知,加入的碳酸钠先与盐酸反应,把盐酸消耗完,才开始与氯化钙反应,开始生成沉淀,故小华同学所取废液中的溶质含CaCl2和HCl;
(4)图1中中b→c段反应过程中是碳酸钠溶液和氯化钙反应,生成沉淀,溶液中性,所以图1中b→c0段反应过程中溶液的pH变化情况可用图2中h-k段曲线表示;
(5)根据题意可知碳酸钠先与盐酸反应,再与氯化钙反应,由图示可知碳酸钠与盐酸反应生成气体2.2g,碳酸钠与氯化钙反应,生成沉淀5.0g.
设生成2.2g气体所需的Na2CO3的质量为y,
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
y 2.2g
$\frac{106}{y}$=$\frac{44}{2.2g}$
解得,y=5.3g;
Na2CO3溶液的质量$\frac{5.3g}{10%}$=53g,所以图1中b点的值为53;
生成沉淀5.0g所需Na2CO3的质量为z.则
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
z 5g
$\frac{106}{z}$=$\frac{100}{5g}$
z=5.3g
Na2CO3溶液的质量$\frac{5.3g}{10%}$=53g,
x的值为53g+53g=106g
故答案为:
【交流讨论】A;
【得出结论】NaHCO3;
【作出猜想】NaOH;
【设计并实验】
(1)NaCl;
(2)白色浑浊,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
【实验反思】
(3)CaCl2和HCl;
(4)h-k;
(5)53,106.
点评 本题考查了破损标签试剂的确定,完成此题,可以依据破损标签的部分已经有关物质的性质进行.要求同学们熟练掌握有关物质的性质,以便灵活应用.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| A. | 铁钉锈蚀实验 | |
| B. | 用注射器探究空气与水哪种物质易被压缩 | |
| C. | 探究影响物质溶解性因素的实验 | |
| D. | 氢氧化钠溶液的酚酞试液中滴加稀盐酸探究中和反应 |
(1)蜡烛在空气中燃烧时生成二氧化碳和水.由此判断蜡烛中一定含有的元素是C、H(填元素符号),判断的依据是反应前后元素的种类不变.
(2)某同学取一根洁净的铜丝,称量其质量为m1 g,将此铜丝加热并冷却后再次称量,其质量为m2 g,则m1< m2 (填“>”、“<”或“=”),产生这一结果的原因是m1中没有包含参加反应的氧气的质量.写出该反应的方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
(3)在密闭容器中放入X、Y、Z、W四种物质并使其发生反应,测得有关数据如下表.关于此反应的认识正确的是AD(填字母序号).
| 物质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 一段时间后的质量(g) | 17 | m | 6 | 11 |
B.该反应为分解反应
C.X与Z的化学计量数之比是3:2
D.若该反应充分进行,反应后W仍有剩余
解析(3):
①先根据质量守恒,计算出m的值:m+17+6+11=2+1+16+16.m=1.
②反应物的特点:反应后的质量比反应前少;生成物的特点:反应后的质量比反应前多.
根据对反应物和生成物的判断,写出反应的表达式:Z+W→X.
③根据表达式以及各物质之间质量关系进行计算.
| A. | 干冰能用于人工降雨 | B. | 二氧化碳用作灭火剂 | ||
| C. | 二氧化碳能用来生产碳酸饮料 | D. | 二氧化碳用作气体肥料 |
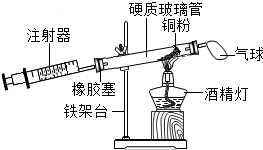
(1)怎样测定硬质玻璃管的容积?向硬质玻璃管中注满水,再把水倒入量筒中,量筒中水的体积即为硬质玻璃管的容积
(2)根据表提供的实验数据,完成此表.
| 硬质玻璃管中空气的体积 | 反应前注射器中的空气体积 | 反应后注射器中的空气体积 | 实验测得空气中氧气的体积分数 |
| 32mL | 18mL | 9mL | 18% |
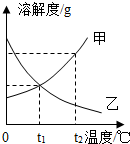 图是甲、乙两物质的溶解度曲线图,下列说法正确的是A.
图是甲、乙两物质的溶解度曲线图,下列说法正确的是A.