题目内容
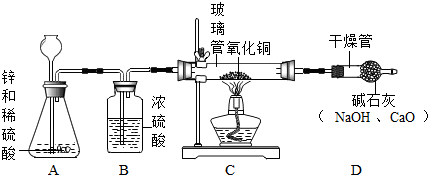
2.如图所示实验操作中,错误的是( )| A. |  加热液体 | B. |  稀释浓硫酸 | C. |  测溶液pH值 | D. |  点燃酒精灯 |
分析 A、给液体加热时,注意试管内液体的量,试管的倾斜度等;
B、根据浓硫酸的稀释方法进行分析判断;
C、根据用pH试纸测定未知溶液的pH的方法进行分析判断;
D、根据酒精灯的点燃方法进行分析判断.
解答 解:A、给液体加热时,①试管内液体不能超过其体积的$\frac{1}{3}$,防止沸腾溅出;②试管与桌面成约45°角,故A正确;
B、稀释浓硫酸时,应把浓硫酸沿器壁慢慢注入水中,同时用玻璃棒不断搅拌,切不可把水倒进浓硫酸里;如果将水注入浓硫酸里,由于水的密度较小,水会浮在浓硫酸的上面,溶解时放出的热量能使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的,故B错误;
C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.故C正确;
D、要用火柴点燃酒精灯,故D正确.
故选B.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.除去下列各物质中的杂质,所用试剂和方法均正确的是( )
| 物质 | 杂质 | 除杂所用试剂和方法 | |
| A | NH3 | 水蒸气 | 通过浓硫酸 |
| B | NaOH溶液 | Na2CO3 | 先加入适量的CaCl2溶液,再过滤 |
| C | CaCl2固体 | CaCO3固体 | 加入过量的稀盐酸,蒸发结晶 |
| D | NaCl | KNO3 | 冷却热饱和溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
7.化学与生活密切相关,下列对生活现象的解释不合理的是( )
| A. | 用3%的过氧化氢溶液进行伤口消毒时常看到有气泡产生,是因为H2O2分解产生了O2 | |
| B. | 压瘪的乒乓球放入热水中重新鼓起,是因为球内的气体分子间隙大 | |
| C. | 灭火时将水喷成细雾状,主要目的是隔离氧气 | |
| D. | 野营篝火时通常将木柴架空,主要是增大木柴与空气的接触面积 |
11.四种微粒的结构示意图如下,其中表示原子的是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列物质在氧气中燃烧的现象描述正确的是( )
| A. | 硫在氧气中燃烧,发出淡蓝色火焰 | |
| B. | 铁丝在氧气中燃烧,生成四氧化三铁 | |
| C. | 红磷在氧气中燃烧,产生大量的白雾 | |
| D. | 木炭在氧气中燃烧,发出白光 |
 A物质的溶解度曲线如图所示.请回答:
A物质的溶解度曲线如图所示.请回答: