题目内容
18.请你分析以下实验装置,并学习所提供的材料、实验装置: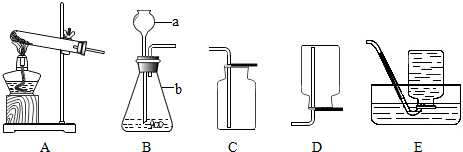
学习材料:氨气(NH3)是一种具有刺激性气味的无色气体,密度比空气小,极易溶于水.氨气能使湿润的红色石蕊试纸变蓝色.实验室可用加热氯化铵和熟石灰两种固体的方法制取氨气【2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O】.
铵盐易溶于水.Ca(OH)2微溶于水.氯化银(AgCl)是白色固体,难溶于水.CaCl2溶液显中性,NH4Cl溶液显酸性.
请回答:
(1)仪器a的名称是长颈漏斗,仪器b的名称是锥形瓶.
(2)用KMnO4制取氧气时,应选用A装置.选用A装置的原因是KMnO4是固体,固体制气体一般需要加热.
(3)实验室欲制取并收集氨气,选取的发生装置是A(填装置编号,下同),收集装置是D.检验氨气是否收集满的操作方法是把湿润的红色石蕊试纸放在集气瓶口,红色变蓝色,证明满了.
某同学对制取氨气反应后反应器内的固体物质进行了进一步的研究:
①取反应器内少量固体于试管中,加水溶解、过滤,得到滤液.
②取少量滤液于试管中,向试管中滴加无色酚酞溶液,溶液颜色无变化,说明固体物质中不含Ca(OH)2.
③另取少量滤液于试管中,向试管中滴加AgNO3溶液,产生白色沉淀,该同学得出了固体物质中一定含有NH4Cl的结论.
你认为“固体物质中一定含有NH4Cl”的结论是否正确否(填“是”或“否”),理由是氯化钙中含有氯离子.
分析 长颈漏斗方便加液体药品,锥形瓶是常用的反应容器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室可用加热氯化铵和熟石灰两种固体的方法制取氨气,因此需要加热;氨气(NH3)是一种具有刺激性气味的无色气体,密度比空气小,极易溶于水,因此氨气只能用向下排空气法收集;氨气的验满方法是:把湿润的红色石蕊试纸放在集气瓶口,红色变蓝色,证明满了.在实验探究中,“固体物质中一定含有NH4Cl”的结论是不正确的,因为氯化钙中含有氯离子.
解答 解:(1)长颈漏斗方便加液体药品,锥形瓶是常用的反应容器,故答案为:长颈漏斗;锥形瓶;
(2)用KMnO4制取氧气时,选用A装置的原因是:KMnO4是固体,固体制气体一般需要加热;故答案为:KMnO4是固体,固体制气体一般需要加热;
(3)实验室可用加热氯化铵和熟石灰两种固体的方法制取氨气,因此需要加热;氨气(NH3)是一种具有刺激性气味的无色气体,密度比空气小,极易溶于水,因此氨气只能用向下排空气法收集;氨气的验满方法是:把湿润的红色石蕊试纸放在集气瓶口,红色变蓝色,证明满了;在实验探究中,“固体物质中一定含有NH4Cl”的结论是不正确的,因为氯化钙中含有氯离子;故答案为:①A;D;把湿润的红色石蕊试纸放在集气瓶口,红色变蓝色,证明满了;②否③氯化钙中含有氯离子;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、气体的验满和氯离子的检验等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

| A. | BaSO4(BaCO3):加水,过滤 | |
| B. | Cu(CuO):过量稀盐酸,过滤 | |
| C. | NaCl溶液(Na2CO3):适量硝酸钙溶液,过滤 | |
| D. | CO(CO2):Fe2O3,高温 |
 ,其相对原子质量为14.下列关于碳-14的说法中,不正确的是( )
,其相对原子质量为14.下列关于碳-14的说法中,不正确的是( )| A. | 核外电子数为6 | |
| B. | 核电荷数等于核外电子数 | |
| C. | 质子数为6 | |
| D. | 核外有两个电子层,第一层有4个电子 |




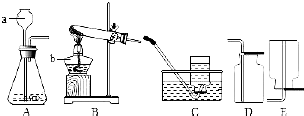 请根据如图所示实验装置回答问题:
请根据如图所示实验装置回答问题: