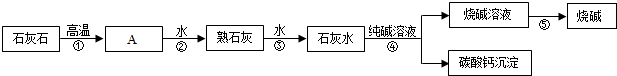
题目内容
20.要除去下列物质中的少量杂质(括号内为杂质),下列实验方案设计中合理的是( )| A. | BaSO4(BaCO3):加水,过滤 | |
| B. | Cu(CuO):过量稀盐酸,过滤 | |
| C. | NaCl溶液(Na2CO3):适量硝酸钙溶液,过滤 | |
| D. | CO(CO2):Fe2O3,高温 |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、BaCO3、BaSO4均难溶于水,用过滤的方法不能除去杂质,不符合除杂原则,故选项所采取的方法错误.
B、CuO能与过量稀盐酸反应生成氯化铜和水,铜不与稀盐酸反应,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
C、Na2CO3能与适量硝酸钙溶液反应生成碳酸钙沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误.
D、CO能与Fe2O3在高温下反应生成铁和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
故选:B.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
11.某白色固体A可能含有碳酸钠、氯化钡(水溶液呈中性)、氢氧化钠中的一种或几种,进行如下实验:
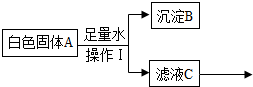
完成下列填空:
①根据上述实验分析,A中一定含有的物质是碳酸钠、氯化钡,写出生成B的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCl.
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成如表.

完成下列填空:
①根据上述实验分析,A中一定含有的物质是碳酸钠、氯化钡,写出生成B的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCl.
②为进一步确定固体A中可能存在的物质,对滤液C进行实验,完成如表.
| 实验操作 | 现象 | 结论 |
| 向滤液C中加入足量的氯化钡溶液,充分反应后,静置,取上层清液滴加无色酚酞 | 无色酚酞变红色 | A中有氢氧化钠 |
8.下列各组离子可在同一溶液中大量共存的是( )
| A. | H+ SO42- K+ CO32- | B. | Mg2+ Cl- OH- Na+ | ||
| C. | Fe3+ SO42- H+ Cl- | D. | Na+ Ba2+ NO3- SO42- |
15.化学改变世界的途径是使物质发生化学变化.下列变化属于化学变化的是( )
| A. |  树根“变”根雕 | B. |  葡萄“变”美酒 | ||
| C. |  玉石“变”印章 | D. |  玩具机器人“变”形 |