题目内容
2.CaCO3在生产生活中有广泛的用途.(1)煅烧石灰石可制得活性CaO,反应的化学方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
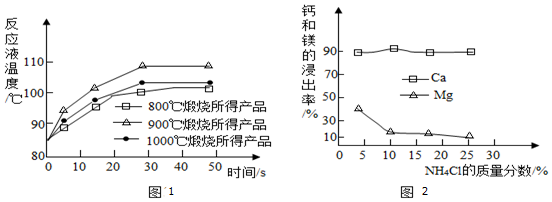
为测定不同煅烧温度对CaO活性的影响,某化学兴趣小组进行了如下实验:
①取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧;
②所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示.据此回答:
①要得出正确结论,煅烧时还需控制的条件是煅烧时间相同.
②CaO与水反应会放出热量(填“放出”或“吸收”);上述温度中,900℃煅烧所得CaO活性最高.
(2)以电石渣【主要成分为Ca(OH)2,还含有少量MgO等杂质】为原料制备高纯活性CaCO3的流程如图3:(资料:氨水的pH约为11.7,氢氧化镁完全沉淀的pH约为10.87)
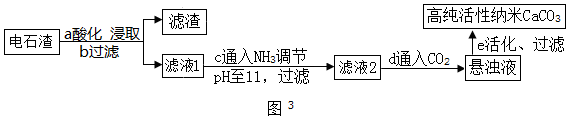
①步骤a中加入的药品为NH4Cl溶液,由此说明NH4Cl溶液的pH<7(选填<、=或>);如图2为NH4Cl浓度对钙、镁浸出率的影响(浸出率=$\frac{进入溶液的某元素质量}{原固体中该元素的总质量}$×100%).可知:较适宜的NH4Cl溶液的质量分数为10%;浸取时主要反应的化学方程式为2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑.
②流程c通入NH3的目的主要有两个,一是调节溶液的pH,二是使镁离子以氢氧化镁沉淀形式析出
③步骤d中生成碳酸钙的反应方程式为CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl.
④向滤液1中滴加Na2CO3溶液,也能得到CaCO3,从节约药品角度分析图3所示流程的优点:Ⅰ.NH3可循环利用;Ⅱ.NH4Cl可循环利用.
分析 (1)高温条件下,碳酸钙分解生成氧化钙和二氧化碳;
根据图中提供的信息可以判断相关方面的问题;
(2)氢氧化钙、氧化镁能和显酸性的物质发生反应;
氯化铵能和氢氧化钙反应生成氯化钙、水和氨气;
氨水属于碱,能和镁离子反应生成氢氧化镁沉淀;
物质的循环利用,既可以节约药品,也可以防止环境污染.
解答 解:(1)煅烧石灰石时,石灰石中的主要成分碳酸钙分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
①要得出正确结论,煅烧时还需控制的条件是煅烧时间相同.
故填:煅烧时间相同.
②CaO与水反应后溶液温度升高,说明反应放出热量;
由表中数据可知,上述温度中,900℃煅烧所得CaO活性最高.
故填:放出;900.
(2)①步骤a中加入的药品为NH4Cl溶液,既然氯化铵能和氧化镁反应,说明氯化铵溶液显酸性,由此说明NH4Cl溶液的pH<7;
如图2所示可知,较适宜的NH4Cl溶液的质量分数为10%,这是因为氯化铵质量分数是10%时,钙的浸出率最大;
浸取时,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑.
故填:<;10%;2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑.
②流程c通入NH3的目的主要有两个,一是调节溶液的pH,二是使镁离子以氢氧化镁沉淀形式析出.
故填:调节溶液的pH;使镁离子以氢氧化镁沉淀形式析出.
③步骤d中,氯化钙和碳酸铵反应生成碳酸钙沉淀和氯化铵,反应的化学方程式为:CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl.
故填:CaCl2+(NH4)2CO3=CaCO3↓+2NH4Cl.
④向滤液1中滴加Na2CO3溶液,也能得到CaCO3,从节约药品角度分析图3所示流程的优点:Ⅰ.NH3可循环利用;Ⅱ. NH4Cl可循环利用.
故填:NH4Cl可循环利用.
点评 步骤d中通入二氧化碳后,二氧化碳能和氨水反应生成碳酸铵,要注意理解.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案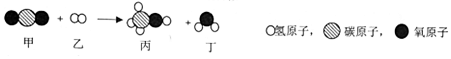
| A. | 反应过程中只有丁属于氧化物 | |
| B. | 发生反应的甲和乙的质量比为22:1 | |
| C. | 可用于减少温室气体的排放 | |
| D. | 反应前后,原子的种数不变,数目改变 |
| A. |  常温下向pH=10的NaOH溶液中不断加入水稀释 | |
| B. |  向等质量的Mg和MgO中分别加入足量等浓度的稀硫酸 | |
| C. | 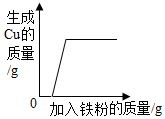 向一定量的Zn(NO3)2和Cu(NO3)2的混合溶液中不断加入铁粉 | |
| D. | 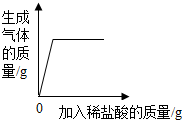 向一定量的部分变质的氢氧化钠溶液中滴加足量的稀盐酸 |
| A. | 酒精、C2H5OH、碱 | B. | 熟石灰、CaCO3、盐 | ||
| C. | 水银、Hg、金属单质 | D. | 纯碱、NaOH、碱 |
| A. | 生活污水随意排放 | |
| B. | 通过加高烟囱排放工业废气 | |
| C. | 提倡步行、骑自行车等“低碳”出行方式 | |
| D. | 施用大量的化肥和农药以提高农作物产量 |

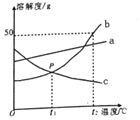 根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
根据如图中a、b、c三种物质的溶解度曲线,回答下列问题: