题目内容
17.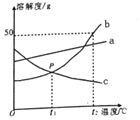 根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:(1)P点表示在t1℃两物质的溶解度关系为b=c(填“>”、“<”或“等于”).
(2)t2℃,a、b、c三种物质的饱和溶液降温到t1℃后,所得溶液中溶质质量分数的大小关系为a>b>c.
(3)t2℃时,50gb物质加入到50g水中充分溶解后,所得溶液中溶质和溶液的质量比为1:3.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)通过分析溶解度曲线可知,P点表示在t1℃两物质的溶解度关系为b=c;
(2)t1℃时,a物质的溶解度最大,b、c物质的溶解度相等,降低温度,a、b物质会析出晶体,c物质不会析出晶体,应该按照t2℃时的溶解度进行计算,所以t2℃,a、b、c三种物质的饱和溶液降温到t1℃后,所得溶液中溶质质量分数的大小关系为:a>b>c;
(3)t2℃时,b物质的溶解度是50g,所以50gb物质加入到50g水中充分溶解后,所得溶液中溶质和溶液的质量比为:25g:(25g+50g)=1:3.
故答案为:(1)=;
(2)a>b>c;
(3)1:3.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.实验操作正确的是( )
| A. |  点燃酒精灯 | B. |  取用粉末状固体 | C. |  取用块状固体 | D. |  加热液体 |
5.下列4个图象中,能正确反映变化关系的是( )
| A | B | C | D |
 |  |  |  |
| 将一瓶浓硫酸露置于空气中 | 向一定质量的稀硫酸中加入锌片 | 加热一定质量的高锰酸钾固体 | 向一定质量的氯化镁和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.我国科学家屠呦呦发现和提取了青蒿素(分子式为C15H22O5),它是一种高效、速效抗疟药,获得2015年诺贝尔医学奖.下列有关青蒿素的叙述正确的是( )
| A. | 由四种元素组成 | |
| B. | 由42个原子构成 | |
| C. | 其中碳、氢、氧元素的质量比为22:22:5 | |
| D. | 其中碳元素的质量分数为63.8% |
9.下列微粒中能保持氢气化学性质的是( )
| A. | 2H | B. | H2 | C. | H | D. | H+ |
7.高铁酸钾(K2FeO4)是一种新型的水处理剂,易溶于水,易与水反应,与水反应的方程式为:4K2FeO4+10H2O═4Fe(OH)3↓+8KOH+3O2↑.下列有关高铁酸钾的分析中,正确的是( )
| A. | 高铁酸钾是一种氧化物 | |
| B. | 用高铁酸钾处理后的水中含大量高铁酸根离子(FeO42-) | |
| C. | 高铁酸钾中铁的化合价是+3价 | |
| D. | 用高铁酸钾净化过的水,pH升高 |
 A、B、C、D为初中化学常见的物质,它们之间存在一定的关系,请根据下列叙述回答问题.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去).
A、B、C、D为初中化学常见的物质,它们之间存在一定的关系,请根据下列叙述回答问题.“-”表示两端的物质能反应,“→”表示物质间存在转化关系.(部分生成物和反应条件已略去).