题目内容
12.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中的碳酸钠质量分数进行实验探究,在老师指导下,他们设计下列两种实验方案进行实验.[查阅资料]:Ⅰ.碳酸钠和氯化钙能发生复分解反应.Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为碳酸钙表面附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).
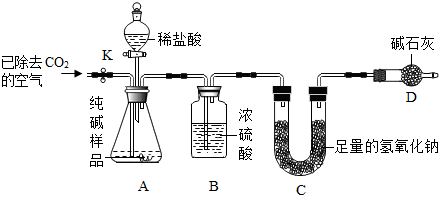
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
分析 (1)碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠;
(2)滴加的CaCl2溶液过量能使碳酸钠完全反应;
(3)如果不洗涤沉淀物时,由于沉淀物上附着有杂质,会导致测定的沉淀物质量偏大;
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳;
(5)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳;
(6)根据质量守恒定律,装置C在反应前后的质量差就是产生CO2的质量;
若没有装置D,空气中的二氧化碳会进入装置C中.
解答 解:(1)取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液,产生白色沉淀,这是因为碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl,实验过程如下表所示:
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
故填:能使碳酸钠完全反应.
(3)利用沉淀物质量计算Na2CO3的质量分数为91%,如果不洗涤沉淀物会造成测定结果大于91%,这是因为碳酸钙表面附着一些杂质,导致测定的碳酸钙质量偏大,从而导致测定结果偏大.
故填:碳酸钙表面附着一些杂质.
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
故填:二氧化碳.
(5)关闭止水夹K,加入足量的稀盐酸,装置A中,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数;
若没有装置D,空气中的二氧化碳会进入装置C中,将会使测定结果偏大.
故填:C;偏大.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列化学实验操作,正确的是( )
| A. |  闻气味 | B. |  称量固体 | C. |  滴加液体 | D. |  稀释浓硫酸 |
20.下列变化中属于物理变化的是( )
| A. | 葡萄糖在人体内缓慢氧化 | B. | 三氧化硫溶于水 | ||
| C. | 冰雪融化 | D. | 蛋白质遇浓硝酸呈黄色 |
7.某物质在空气中完全燃烧生成4.4g二氧化碳和2.7g水,则关于这种物质的组成描述正确的是( )
| A. | 该物质的化学式可能为C2H6O | |
| B. | 该物质的分子中碳原子与氢原子的个数比为1:2 | |
| C. | 该物质只含有碳元素和氢元素 | |
| D. | 该物质中碳元素与氢元素的质量比为12:1 |
10.下列四个图象中,能正确反映对应变化关系的是( )
| A. |  表示向部分变质的NaOH溶液中滴加稀盐酸至过量 表示向部分变质的NaOH溶液中滴加稀盐酸至过量 | |
| B. |  表示向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌 表示向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌 | |
| C. |  表示将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出 表示将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出 | |
| D. |  表示向一定量的盐酸和氯化钙溶液的混合物中不断滴入碳酸钠溶液 表示向一定量的盐酸和氯化钙溶液的混合物中不断滴入碳酸钠溶液 |
11.下列关于燃烧与灭火的说法,正确的是( )
| A. | 住房着火,消防队员用水灭火,是为了降低可燃物的着火点 | |
| B. | 燃着的镁带在二氧化碳中会继续燃烧,因此镁等活泼金属着火不能用二氧化碳灭火 | |
| C. | 放在空气中的课本没有燃烧,是因为课本不是可燃物 | |
| D. | 油锅着火,用锅盖盖上,是为了降低可燃物的温度 |

 向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示.请根据关系图分析并计算:
向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示.请根据关系图分析并计算: