题目内容
11.下列关于燃烧与灭火的说法,正确的是( )| A. | 住房着火,消防队员用水灭火,是为了降低可燃物的着火点 | |
| B. | 燃着的镁带在二氧化碳中会继续燃烧,因此镁等活泼金属着火不能用二氧化碳灭火 | |
| C. | 放在空气中的课本没有燃烧,是因为课本不是可燃物 | |
| D. | 油锅着火,用锅盖盖上,是为了降低可燃物的温度 |
分析 可燃物燃烧时的条件是:可燃物与氧气接触并且温度达到可燃物的着火点;灭火的原理是:隔绝可燃物或降低温度到可燃物的着火点以下或者隔绝氧气.根据灭火的原理与燃烧的条件分析即可.
解答 解:A、着火点一般是固定不变的,用水扑灭是因为降低了可燃物的温度到着火点以下,所以错误.
B、镁能在二氧化碳中燃烧,所以不能用二氧化碳来灭火,故正确.
C、课本是可燃物,放置在空气中已与氧气接触,没有燃烧是因为课本的温度没有达到着火点,所以错误.
D、油锅着火,用锅盖盖上,是为了隔绝氧气灭火,所以错误.
故选B.
点评 燃烧是人类最早利用的反应,燃烧在为人带来热量服务于人类的同时也会为人类带来灾难,燃烧的条件和灭火的方法,为人类提供了安全利用燃烧反应的保障,是中考的热点题目之一.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
12.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中的碳酸钠质量分数进行实验探究,在老师指导下,他们设计下列两种实验方案进行实验.
[查阅资料]:Ⅰ.碳酸钠和氯化钙能发生复分解反应.Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
(2)分析滴加的CaCl2溶液要过量的原因:使样品中的碳酸钠完全反应;
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为碳酸钙表面附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).
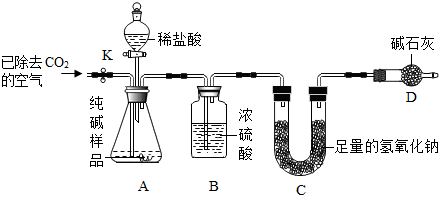
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
[查阅资料]:Ⅰ.碳酸钠和氯化钙能发生复分解反应.Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为碳酸钙表面附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).

(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
2.下列化学方程式中,书写正确的是( )
| A. | HgO2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+O2↑ | B. | Al+2HCl═AlCl3+H2↑ | ||
| C. | Cu+FeSO4═CuSO4+Fe | D. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
19.下列说法正确的是( )
| A. | 空气中氧气的体积分数为21% | B. | 生成盐和水的反应一定是中和反应 | ||
| C. | 原子形成离子电子层数一定改变 | D. | 玻璃钢属于金属材料 |
6.实验室常用下列装置来制取、收集气体.仪器b是分液漏斗,可通过旋转活塞分次滴加液体.请回答以下问题.

(1)仪器a、c的名称是:a锥形瓶,c水槽.
(2)实验室用氯酸钾制取氧气,应选用的发生装置和收集装置的组合为AF或AH(填字母序号),该反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.收集装置的选择是由气体的性质决定的.既能用排水法也能用排空气法收集的气体一定具有的性质有①③④(填数字序号).
①难溶于水 ②易溶于水 ③不与水反应 ④密度与空气不接近
⑤可与空气中某成分反应 ⑥有毒,是一种大气污染物
(3)实验室要制取少量CO2应选择的较简单的发生装置是E(填字母序号).
某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,请将可能的原因填入如表(答出一条即可),并用简单的实验进行验证:
(4)常温下块状电石(CaC2)与水反应生成乙炔(C2H2)气体和氢氧化钙,该反应的化学方程式是CaC2+2H2O=Ca(OH)2+C2H2↑.实验室制取乙炔时,须严格控制加水速度,以免剧烈反应放热引起装置炸裂.上图中适合制取乙炔气体的发生装置有CD
(填装置序号).
(5)通过查阅资料得知:
①氨气是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;
②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体.
小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生和收集装置是AG(填字母),发生反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
③请写出氨气和氧化铜反应的化学方程式2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.

(1)仪器a、c的名称是:a锥形瓶,c水槽.
(2)实验室用氯酸钾制取氧气,应选用的发生装置和收集装置的组合为AF或AH(填字母序号),该反应的化学方程式是2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.收集装置的选择是由气体的性质决定的.既能用排水法也能用排空气法收集的气体一定具有的性质有①③④(填数字序号).
①难溶于水 ②易溶于水 ③不与水反应 ④密度与空气不接近
⑤可与空气中某成分反应 ⑥有毒,是一种大气污染物
(3)实验室要制取少量CO2应选择的较简单的发生装置是E(填字母序号).
某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,请将可能的原因填入如表(答出一条即可),并用简单的实验进行验证:
| 可能的原因 | 实验步骤 | 实验现象 | 实验结论 |
| 猜想的结论正确 |
(填装置序号).
(5)通过查阅资料得知:
①氨气是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;
②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多的气体.
小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应选择的反应的发生和收集装置是AG(填字母),发生反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
③请写出氨气和氧化铜反应的化学方程式2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
1.下列关于溶液的说法,正确的是( )
| A. | 不饱和溶液转化为饱和溶液时,其溶质的质量分数一定会增大 | |
| B. | 饱和溶液中析出晶体后,其溶质的质量分数一定不变 | |
| C. | 饱和溶液温度降低时,一定会有晶体析出 | |
| D. | 饱和溶液恒温蒸发溶剂时,其溶质的质量分数一定不变 |




 .
.