题目内容
2.下列化学实验操作,正确的是( )| A. |  闻气味 | B. |  称量固体 | C. |  滴加液体 | D. |  稀释浓硫酸 |
分析 A、根据闻气体的气味时的方法(招气入鼻法)进行分析判断.
B、根据托盘天平的使用要遵循“左物右码”的原则进行分析判断.
C、根据使用胶头滴管滴加少量液体的方法进行分析判断.
D、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断.
解答 解:A、闻气体的气味时,应用手在瓶口轻轻的扇动,使极少量的气体飘进鼻子中,不能将鼻子凑到集气瓶口去闻气体的气味,图中所示操作正确.
B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,图中所示操作错误.
C、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误.
D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作错误.
故选:A.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
10.下列变化过程中,涉及化学变化的是( )
| A. |  干冰升华 | B. |  海水晒盐 | C. |  风力发电 | D. |  火箭发射 |
17.以太阳能为热源,硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图所示:

反应Ⅱ的化学方程式为2H2SO4=2SO2↑+O2↑+2H2O,它由两步反应组成:
第一步:H2SO4=SO3↑+H2O;第二步:SO3分解.
下列说法中正确的是( )

反应Ⅱ的化学方程式为2H2SO4=2SO2↑+O2↑+2H2O,它由两步反应组成:
第一步:H2SO4=SO3↑+H2O;第二步:SO3分解.
下列说法中正确的是( )
| A. | 反应Ⅰ方程式为:SO2+I2+2H2O=H2SO4+2HI | |
| B. | 反应Ⅱ中的第二步反应中,SO3分解生成S和O2 | |
| C. | 反应Ⅰ属于化合反应,反应Ⅱ、III属于分解反应 | |
| D. | 该生产工艺中最终被消耗的物质是H2O、S和I2 |
7.下列区分物质的方法不正确的是( )
| A. | 毛织品和棉织品-点燃少许样品并闻气味 | |
| B. | 钾肥和铵态氮肥-加熟石灰研磨,闻气味 | |
| C. | 氢气、一氧化碳-通入灼热的氧化铜,看固体颜色变化 | |
| D. | 黄金和黄铜(铜锌合金)-加入稀盐酸中,观察是否有气泡产生 |
11.下列生活经验中,不正确的是( )
| A. | 用氢氧化钙治疗胃酸过多 | |
| B. | 用硫酸钡作胃部 X 光检查时服用的“钡餐” | |
| C. | 用食醋除去水瓶中的水垢 | |
| D. | 用铅笔芯的粉末使锁的开启变得更灵活 |
12.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中的碳酸钠质量分数进行实验探究,在老师指导下,他们设计下列两种实验方案进行实验.
[查阅资料]:Ⅰ.碳酸钠和氯化钙能发生复分解反应.Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
(2)分析滴加的CaCl2溶液要过量的原因:使样品中的碳酸钠完全反应;
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为碳酸钙表面附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).
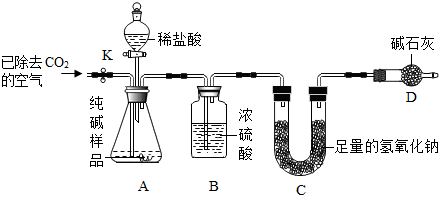
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
[查阅资料]:Ⅰ.碳酸钠和氯化钙能发生复分解反应.Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为碳酸钙表面附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).

(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).

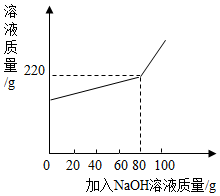 将一定量氯化镁和氯化钠的固体混合物加水配成145.8g的溶液,向所得溶液中加入一定浓度的氢氧化钠溶液,加入氢氧化钠溶液的质量与反应后溶液的质量关系如图.计算:
将一定量氯化镁和氯化钠的固体混合物加水配成145.8g的溶液,向所得溶液中加入一定浓度的氢氧化钠溶液,加入氢氧化钠溶液的质量与反应后溶液的质量关系如图.计算: