题目内容
10.下列四个图象中,能正确反映对应变化关系的是( )| A. |  表示向部分变质的NaOH溶液中滴加稀盐酸至过量 表示向部分变质的NaOH溶液中滴加稀盐酸至过量 | |
| B. |  表示向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌 表示向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌 | |
| C. |  表示将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出 表示将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出 | |
| D. |  表示向一定量的盐酸和氯化钙溶液的混合物中不断滴入碳酸钠溶液 表示向一定量的盐酸和氯化钙溶液的混合物中不断滴入碳酸钠溶液 |
分析 A、氢氧化钠能和二氧化碳反应生成碳酸钠和水,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠和稀盐酸反应生成氯化钠和水;
B、镁比锌活泼,和稀硫酸反应时镁和稀硫酸的反应速率较快;
C、饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%;
D、向一定量的盐酸和氯化钙溶液的混合物中不断滴入碳酸钠溶液时,碳酸钠先和盐酸反应生成氯化钠、水和二氧化碳,后和氯化钙反应生成碳酸钙沉淀和氯化钠.
解答 解:A、向部分变质的NaOH溶液中滴加稀盐酸至过量时,稀盐酸先和氢氧化钠反应生成氯化钠和水,后和碳酸钠反应生成氯化钠、水和二氧化碳,该选项对应关系正确;
B、向溶质质量分数相同、等质量的稀硫酸中分别加入足量的金属镁和锌时,最终生成氢气的质量相等,由于镁比锌活泼,和稀硫酸反应时镁和稀硫酸的反应速率较快,反应需要时间短,该选项对应关系不正确;
C、将一定质量的不饱和硝酸钾溶液恒温蒸发至有晶体析出时,达到饱和状态前,由于水的不断蒸发,溶液质量不断减小,溶质质量不变,因此溶质质量分数不断增大,当达到饱和状态时,溶质质量分数决定于溶解度,由于是恒温蒸发,因此溶解度不变,即达到饱和状态后,继续蒸发水时,溶质质量分数不变,该选项对应关系不正确;
D、向一定量的盐酸和氯化钙溶液的混合物中不断滴入碳酸钠溶液时,碳酸钠先和盐酸反应生成氯化钠、水和二氧化碳,随着反应进行,溶液质量增大,后和氯化钙反应生成碳酸钙沉淀和氯化钠,随着反应进行,溶液质量不断增大,当氯化钙完全反应后继续加入碳酸钠溶液时,溶液质量增大,该选项对应关系不正确.
故选:A.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
11.下列生活经验中,不正确的是( )
| A. | 用氢氧化钙治疗胃酸过多 | |
| B. | 用硫酸钡作胃部 X 光检查时服用的“钡餐” | |
| C. | 用食醋除去水瓶中的水垢 | |
| D. | 用铅笔芯的粉末使锁的开启变得更灵活 |
12.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中的碳酸钠质量分数进行实验探究,在老师指导下,他们设计下列两种实验方案进行实验.
[查阅资料]:Ⅰ.碳酸钠和氯化钙能发生复分解反应.Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
(2)分析滴加的CaCl2溶液要过量的原因:使样品中的碳酸钠完全反应;
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为碳酸钙表面附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).
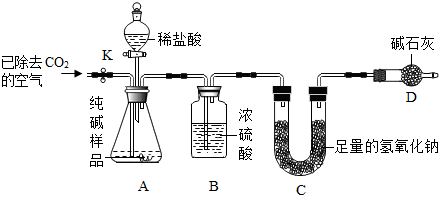
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
[查阅资料]:Ⅰ.碳酸钠和氯化钙能发生复分解反应.Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为碳酸钙表面附着一些杂质.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).

(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据质量守恒定律,装置C(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果偏大(选填“偏大”或“偏小”).
2.下列化学方程式中,书写正确的是( )
| A. | HgO2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+O2↑ | B. | Al+2HCl═AlCl3+H2↑ | ||
| C. | Cu+FeSO4═CuSO4+Fe | D. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
19.下列说法正确的是( )
| A. | 空气中氧气的体积分数为21% | B. | 生成盐和水的反应一定是中和反应 | ||
| C. | 原子形成离子电子层数一定改变 | D. | 玻璃钢属于金属材料 |
 如图表示某些物质间的转化关系(反应条件和部分产物已省略).常温下A、C是由相同元素组成的无色液体,且C是一种最常用的溶剂;D、I、J均为无色气体,其中I能使澄清石灰水变浑浊;K为红棕色粉末.请回答下列问题:
如图表示某些物质间的转化关系(反应条件和部分产物已省略).常温下A、C是由相同元素组成的无色液体,且C是一种最常用的溶剂;D、I、J均为无色气体,其中I能使澄清石灰水变浑浊;K为红棕色粉末.请回答下列问题:
 .
.