题目内容
10.下列化学小实验中不涉及化学变化的是( )| A. | 用食醋除水壶壁上的水垢 | B. | 用活性炭除天然水中的臭味物质 | ||
| C. | 用蜡烛不充分燃烧制炭黑 | D. | 用柠檬酸、小苏打、水等自制汽水 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断.
解答 解:A、用食醋除水壶壁上的水垢过程中有新物质二氧化碳等生成,属于化学变化.
B、用活性炭除天然水中的臭味物质过程中没有新物质生成,属于物理变化.
C、用蜡烛不充分燃烧制炭黑过程中有新物质生成,属于化学变化.
D、用柠檬酸、小苏打、水等自制汽水过程中有新物质二氧化碳等生成,属于化学变化.
故选B.
点评 本题难度不大,解答时要分析变化过程中是否有新物质生成,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
18.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如表:下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 54 | 17 | 20 | 10 |
| 反应后的质量/g | 10 | 0 | 2 | x |
| A. | x为89 | B. | 参加反应的丙物质的质量为20 g | ||
| C. | 该反应为分解反应 | D. | 甲物质全部反应完 |
5.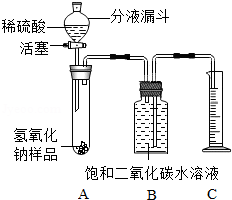 某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.
某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.
实验步骤如下:
①按图连接好装置;
②用天平准确称取氢氧化钠样品m g,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和二氧化碳水溶液v mL.
④计算氢氧化钠样品中碳酸钠的质量分数.
请回答下列问题:
(1)准确判断氢氧化钠发生变质的实验现象是A中有气泡产生;写出氢氧化钠发生变质的化学方程式2NaOH+CO2═Na2CO3+H2O.
(2)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是:检查装置气密性.
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是:避免二氧化碳溶解在水里而损耗,造成测定结果偏低.
(4)判断实验步骤③中滴入的稀硫酸已过量的标志是滴入稀硫酸,A中不再有气泡产生.
(5)叙述检验氢氧化钠部分变质的方法:
(6)用上述装置不能准确测定已部分变质的氢氧化钠样品中氢氧化钠的质量分数,理由是氢氧化钠样品中除了碳酸钠,还有水.
(7)取10g变质的氢氧化钠于烧杯中,其中碳元素的质量分数为6%,向烧杯中加入100g一定质量分数的稀盐酸(足量),则反应结束后烧杯内物质的总质量是107.8g.
 某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.
某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.实验步骤如下:
①按图连接好装置;
②用天平准确称取氢氧化钠样品m g,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和二氧化碳水溶液v mL.
④计算氢氧化钠样品中碳酸钠的质量分数.
请回答下列问题:
(1)准确判断氢氧化钠发生变质的实验现象是A中有气泡产生;写出氢氧化钠发生变质的化学方程式2NaOH+CO2═Na2CO3+H2O.
(2)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是:检查装置气密性.
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是:避免二氧化碳溶解在水里而损耗,造成测定结果偏低.
(4)判断实验步骤③中滴入的稀硫酸已过量的标志是滴入稀硫酸,A中不再有气泡产生.
(5)叙述检验氢氧化钠部分变质的方法:
| 实验步骤 | 实验现象 | 实验结论 |
| 1取样,溶于水,滴加过量的氯化钙溶液 | 产生白色沉淀 | 氢氧化钠部分变质 |
| 2静置,向上层清液中滴加酚酞溶液 | 变红色 |
(7)取10g变质的氢氧化钠于烧杯中,其中碳元素的质量分数为6%,向烧杯中加入100g一定质量分数的稀盐酸(足量),则反应结束后烧杯内物质的总质量是107.8g.
15.硫酸亚铁铵晶体俗名为摩尔盐,在制药、电镀方面有广泛的应用.
资料:①硫酸亚铁铵晶体化学式为FeSO4•(NH4)2SO4•6H2O,相对分子质量为392,易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如表:
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去.
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如图:

(1)操作①中发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑;
(2)过滤所需的玻璃仪器有烧杯、玻璃棒、漏斗;
(3)操作①中过滤时,要趁热进行的原因是防止温度降低FeSO4晶体析出,产量(产率)降低或使FeSO4尽可能多的溶解,提高产量(产率);
(4)操作②的目的是得到硫酸亚铁铵晶体.操作顺序是b→c→a→d;
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(5)操作②中使用乙醇洗涤,可快速晾干.这样做的优点是AB;
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
(6)该实验取废铁屑15g,最终得到硫酸亚铁铵晶体39.2g,则原废铁屑中铁元素的质量分数不低于37.3(精确到0.1%,不要求写过程).
资料:①硫酸亚铁铵晶体化学式为FeSO4•(NH4)2SO4•6H2O,相对分子质量为392,易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如表:
| 温度/℃ | FeSO4 | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O |
| 10 | 20.0 | 73 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78 | 28.1 |
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如图:

(1)操作①中发生反应的化学方程式为Fe+H2SO4═FeSO4+H2↑;
(2)过滤所需的玻璃仪器有烧杯、玻璃棒、漏斗;
(3)操作①中过滤时,要趁热进行的原因是防止温度降低FeSO4晶体析出,产量(产率)降低或使FeSO4尽可能多的溶解,提高产量(产率);
(4)操作②的目的是得到硫酸亚铁铵晶体.操作顺序是b→c→a→d;
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(5)操作②中使用乙醇洗涤,可快速晾干.这样做的优点是AB;
A.避免用水洗涤所造成的晶体损耗
B.酒精易挥发,可低温晾干晶体
(6)该实验取废铁屑15g,最终得到硫酸亚铁铵晶体39.2g,则原废铁屑中铁元素的质量分数不低于37.3(精确到0.1%,不要求写过程).
19.某纯碱样品中含有氯化钠,某化学小组为了测定该样品的纯度,取一定质量的样品,向其中加入一定质量的稀盐酸,恰好完全反应后,得到10%的不饱和的氯化钠溶液,有关实验数据如下:
请计算:
(1)得到的氯化钠溶液中溶质的质量为4.22g;
(2)该纯碱样品的纯度.
| 实验前所取样品的质量 | 实验后得到的氯化钠溶液的质量 |
| 4.00g | 42.20g |
(1)得到的氯化钠溶液中溶质的质量为4.22g;
(2)该纯碱样品的纯度.
9.近来,各地出现了严重的雾霾天气,严重影响人们的身体健康.霾可用PM2.5指标衡量,PM2.5是指大气中小于或等于2.5微米颗粒物,为降低PM2.5的含量,下列做法不应提倡的是( )
| A. | 大量植树造林 | B. | 直接大量燃烧煤炭 | ||
| C. | 充分利用太阳能 | D. | 多骑自行车,少开汽车 |
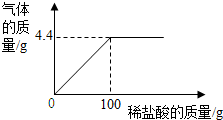 为测量Na2CO3和NaCl组成的样品中NaCl的质量分数,取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如图所示的曲线关系.(水的密度为1g/mL,质量分数计算结果精确到0.1%)
为测量Na2CO3和NaCl组成的样品中NaCl的质量分数,取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如图所示的曲线关系.(水的密度为1g/mL,质量分数计算结果精确到0.1%)