题目内容
18.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如表:下列说法正确的是( )| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 54 | 17 | 20 | 10 |
| 反应后的质量/g | 10 | 0 | 2 | x |
| A. | x为89 | B. | 参加反应的丙物质的质量为20 g | ||
| C. | 该反应为分解反应 | D. | 甲物质全部反应完 |
分析 根据表中的数据和质量守恒定律进行分析.反应中,反应物质量会减少,生成物质量会增加,从而判断生成物与反应物,再利用质量关系进行求解.
解答 解:A.根据质量守恒定律可知:反应前各物质的质量总和=反应后生成各物质的质量总和,所以x=54+17+20+10-10-0-2=89;故正确;
B.反应后丙的质量减少了20g-2g=18g,即参加反应的丙的质量为18g,故错误;
C.根据反应中反应物质量会减少,生成物质量会增加,可以判断反应物为:甲、乙和丙,而生成物为丁,所以可以判断该反应属于化合反应,故错误;
D.由表格信息可知,反应后剩余甲的质量为10g,并没有完全参与反应,故错误.
故选A.
点评 此题是有关质量守恒定律的考查题,解题的关键是利用质量守恒定律对相关量的分析与判断,并进而对反应的类型及质量关系进行探讨.

练习册系列答案
相关题目
13.乳酸具有帮助消化、增进食欲的功能.“某品牌”酸奶中含有乳酸,其化学式为C3H6O3.下列关于乳酸的说法错误的是( )
| A. | 一个乳酸分子共含有12个原子 | |
| B. | 乳酸由碳、氢、氧三种元索组成 | |
| C. | 乳酸中碳、氢、氧元素的质量比为3:6:3 | |
| D. | 乳酸是一种有机物 |
10.下列化学小实验中不涉及化学变化的是( )
| A. | 用食醋除水壶壁上的水垢 | B. | 用活性炭除天然水中的臭味物质 | ||
| C. | 用蜡烛不充分燃烧制炭黑 | D. | 用柠檬酸、小苏打、水等自制汽水 |
17.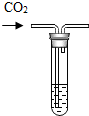 小明同学在实验室中进行如下实验,请你和他一起完成.
小明同学在实验室中进行如下实验,请你和他一起完成.
(1)配制100g质量分数为20%的氢氧化钠溶液,他应称量的氢氧化钠固体质量为20g.配制过程中应用到的玻璃仪器有:量筒、烧杯、玻璃棒,称量氢氧化钠时,应将其放入玻璃器皿中称量,这是因为氢氧化钠具有吸水性且其水溶液具有强烈的腐蚀性.经精确测定,小明配制的溶液溶质质量分数小于20%,你认为其可能的原因是(写一条)使用量筒读数时仰视.
(2)小明取部分配制好的溶液做了如图所示的实验(其他仪器已略去):反应的化学方程式为CO2+2NaOH═Na2CO3+H2O.
(3)通入一段时间CO2后,小明想对试管中的溶液组成进行探究.
【提出问题】溶液中的溶质有哪些物质?
【猜想】Ⅰ:只有氢氧化钠;
Ⅱ、既有氢氧化钠又有碳酸钠;
Ⅲ、只有碳酸钠.
【查阅资料】CaCl2溶液呈中性,能与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠.
【实验探究】小明设计了如下实验进行验证,请完成下表中的空格.
【反思与评价】实验②、③中都滴入了稍过量的CaCl2稀溶液,其目的是:可以完全除去碳酸钠,可否用稀盐酸替代CaCl2溶液?理由是不可以,盐酸可以和碳酸钠和氢氧化钠反应.
 小明同学在实验室中进行如下实验,请你和他一起完成.
小明同学在实验室中进行如下实验,请你和他一起完成.(1)配制100g质量分数为20%的氢氧化钠溶液,他应称量的氢氧化钠固体质量为20g.配制过程中应用到的玻璃仪器有:量筒、烧杯、玻璃棒,称量氢氧化钠时,应将其放入玻璃器皿中称量,这是因为氢氧化钠具有吸水性且其水溶液具有强烈的腐蚀性.经精确测定,小明配制的溶液溶质质量分数小于20%,你认为其可能的原因是(写一条)使用量筒读数时仰视.
(2)小明取部分配制好的溶液做了如图所示的实验(其他仪器已略去):反应的化学方程式为CO2+2NaOH═Na2CO3+H2O.
(3)通入一段时间CO2后,小明想对试管中的溶液组成进行探究.
【提出问题】溶液中的溶质有哪些物质?
【猜想】Ⅰ:只有氢氧化钠;
Ⅱ、既有氢氧化钠又有碳酸钠;
Ⅲ、只有碳酸钠.
【查阅资料】CaCl2溶液呈中性,能与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠.
【实验探究】小明设计了如下实验进行验证,请完成下表中的空格.
| 编号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 取试管中溶液少许,滴入适量的稀盐酸 | 有气泡产生 | 猜想Ⅰ错误. |
| ② | 取试管中溶液少许,滴入稍过量的CaCl2稀溶液,过滤后,向澄清滤液中滴入无色酚酞试液 | 溶液变浑浊,有沉淀产生,溶液变成红色. | 猜想Ⅱ正确. |
| ③ | 取试管中溶液少许,滴入稍过量的CaCl2稀溶液,过滤后,向滤液中加入滴入无色酚酞试液. | 澄清滤液中加入试液后,无明显现象. | 猜想Ⅲ正确. |
 现有A、B、C、D、E、F、G七种物质,C和F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:
现有A、B、C、D、E、F、G七种物质,C和F是最常见的金属,B是气体单质,D为浅绿色溶液,G为蓝色溶液,它们之间存在如下关系:

 哈尔滨市“滨江湿地公园”是集湿地观赏、亲水游乐、休闲度假为一体的湿地公园,它将被打造成为国家5A级湿地旅游风景区.“湿地蘑菇采摘园”种植的蘑菇主要为人体提供的营养素为维生素,其作用为调节新陈代谢,预防疾病,维持身体健康;种植蘑菇期间,为使蘑菇抗寒抗旱,同时提高植物体内蛋白质的含量,农民经常要施加的一种化肥为NH4H2PO4(具体的化学式),农民在施用此化肥时不能与草木灰同时施用的主要原因是草木灰显碱性,与铵态氮肥混合使用会丧失肥效.肥料使用过程中提倡使用适量,合理施用化肥,否则会造成水体污染,水体污染的危害为水体富营养化;请举出你在生活中防治水体污染的具体措施:电池不随便乱扔.
哈尔滨市“滨江湿地公园”是集湿地观赏、亲水游乐、休闲度假为一体的湿地公园,它将被打造成为国家5A级湿地旅游风景区.“湿地蘑菇采摘园”种植的蘑菇主要为人体提供的营养素为维生素,其作用为调节新陈代谢,预防疾病,维持身体健康;种植蘑菇期间,为使蘑菇抗寒抗旱,同时提高植物体内蛋白质的含量,农民经常要施加的一种化肥为NH4H2PO4(具体的化学式),农民在施用此化肥时不能与草木灰同时施用的主要原因是草木灰显碱性,与铵态氮肥混合使用会丧失肥效.肥料使用过程中提倡使用适量,合理施用化肥,否则会造成水体污染,水体污染的危害为水体富营养化;请举出你在生活中防治水体污染的具体措施:电池不随便乱扔.