题目内容
12.每年的6-7月,新疆的许多地区都要举办“薰衣草”节.薰衣草精油的主要成分为芳樟醇、伽罗木醇等物质.其中芳樟醇的化学式为C10H18O,请计算:(1)芳樟醇分子中的原子个数比为C、H、O原子个数比10:18:1.
(2)芳樟醇的相对分子质量是(154),计算该物质组成中氧元素的质量分数为10.4%(精确到0.1%)
分析 (1)根据芳樟醇的化学式为C10H18O分析,
(2)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
解答 解:(1)芳樟醇的化学式为(C10H18O)可知,一个芳樟醇分子是由10个碳原子18个氢原子1个氧原子构成的,芳樟醇分子中C、H、O三种元素的原子个数比为10:18:1,故填:C、H、O原子个数比=10:18:1;
(2)该物质组成中氧元素的质量分数为$\frac{16}{154}$×100%=10.4%.故填:10.4%.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列是生活中常见的现象,不属于化学变化的是( )
| A. | 菜刀生锈 | B. | 米饭变馊 | C. | 马铃薯腐烂 | D. | 用淘米水洗菜 |
3.下列图象与所对应操作相符的是( )
| A. |  用两份等质量、等质量分数的过氧化氢溶液制取氧气 | |
| B. |  向一定质量分数的盐酸中不断加水 | |
| C. |  向等质量的锌片、镁片中分别加入足量的等质量分数的稀硫酸 | |
| D. |  向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液 |
20.某博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是( )
| A. | 定期用清水冲洗,除去灰尘 | B. | 放于体验区,让观众触摸 | ||
| C. | 用盐水除去铁剑上的锈斑 | D. | 放在充满氮气的展览柜中 |
17.甲、乙两种物质的溶解度曲线如图所示.下列说法正确的是( )


| A. | 依据溶解度曲线可判断,甲的溶解度比乙大 | |
| B. | 10℃时,甲、乙饱和溶液溶质的质量相同 | |
| C. | 20℃时,把30g甲放入50g水中形成的溶液中溶质质量分数为37.5% | |
| D. | 将20℃时的甲、乙饱和溶液升温至30℃,甲、乙溶液中溶质的质量分数均不变 |
4.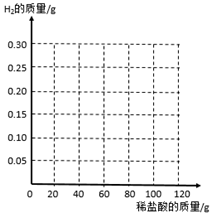 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
(1)第5次加入稀盐酸时,烧杯中烧杯中溶质是AlCl3、HCl
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
1.现有25g的KOH和K2CO3固体混合物,已知K元素与C元素的质量比是39:3,把该固体全部加入到盛有100g的足量稀硫酸的烧杯中,充分反应后,烧杯里残留物质的质量是120.6g,则烧杯中硫酸钾的质量为( )
| A. | 4.8g | B. | 9.6g | C. | 17.4g | D. | 34.8g |
2.干冰和二氧化碳气体都是由二氧化碳分子直接构成的.对于两者中的二氧化碳分子的比对结果,正确的是( )
| A. | 分子运动速率相同 | B. | 分子之间相互作用的强弱相同 | ||
| C. | 化学性质相同 | D. | 分子之间的间隔相同 |
