题目内容
3.下列图象与所对应操作相符的是( )| A. |  用两份等质量、等质量分数的过氧化氢溶液制取氧气 | |
| B. |  向一定质量分数的盐酸中不断加水 | |
| C. |  向等质量的锌片、镁片中分别加入足量的等质量分数的稀硫酸 | |
| D. |  向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液 |
分析 A、过氧化氢分解生成水和氧气;
B、稀释盐酸时酸性减弱,pH升高;
C、稀硫酸和镁反应生成硫酸镁和氢气,和锌反应生成硫酸锌和氢气,镁比锌活泼;
D、向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液时,氢氧化钠先和稀盐酸反应生成氯化钠和水,后和氯化铜反应生成氢氧化铜沉淀和氯化钠.
解答 解:A、过氧化氢分解生成水和氧气,有催化剂时分解速率快一些,但是最终得到的氧气质量相等,该选项对应关系不正确;
B、稀释盐酸时酸性减弱,pH升高,但是不能升高到7,更不能大于7,该选项对应关系不正确;
C、稀硫酸和镁反应生成硫酸镁和氢气,和锌反应生成硫酸锌和氢气,反应的化学方程式及其质量关系为:
Mg+H2SO4═MgSO4+H2↑,Zn+H2SO4═ZnSO4+H2↑,
24 2 65 2
由以上质量关系可知,等质量的锌片、镁片和足量稀硫酸反应时,最终镁和稀硫酸反应生成的氢气多,该选项对应关系不正确;
D、向一定质量的氯化铜和稀盐酸的混合溶液中不断加NaOH溶液时,氢氧化钠先和稀盐酸反应生成氯化钠和水,后和氯化铜反应生成氢氧化铜沉淀和氯化钠,该选项对应关系正确.
故选:D.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
14.实验室有一份部分被氧化成氧化镁的镁粉样品,未知浓度盐酸和40%的氢氧化钠溶液,兴趣小组同学为分析样品中金属镁的质量分数含量和计算盐酸的质量分数,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
镁粉样品中金属镁的质量百分含量为75.0%.
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示.计算盐酸的质量分数.(写出计算过程)
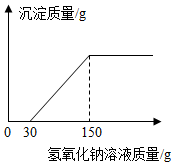
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
| 实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
| Ⅰ | 16.0 | 60.0 | 0.5 |
| Ⅱ | 16.0 | 130.0 | 1.0 |
| Ⅲ | 16.0 | 150.0 | 1.0 |
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示.计算盐酸的质量分数.(写出计算过程)

11.PLA是一种新型可降解塑料,以乳酸(C3H6O3)为主要原料聚合而成,下列有关乳酸的说法错误的是( )
| A. | 乳酸是由碳、氢、氧三种元素组成 | B. | 乳酸分子中含有12个原子 | ||
| C. | 乳酸的相对分子质量是90 | D. | 乳酸中氧元素的质量分数最大 |
18.下列做法中不合理的是( )
| A. | 发现燃气泄漏应立即关闭阀口、开窗通风 | |
| B. | 铝制品变旧变暗后用砂纸或钢丝球打磨 | |
| C. | 点燃可燃性气体之前必须验纯 | |
| D. | 浓硫酸溅到皮肤上,立即用大量水冲洗,再涂上3%~5%的小苏打溶液 |
8.化学元素含量的多少对人体健康有着重要的影响.人体缺钙易引发的疾病是( )
| A. | 贫血 | B. | 夜盲症 | C. | 骨质疏松 | D. | 甲状腺肿大 |
15. 有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.
有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.
Ⅰ.取样品20g,倒入容积为200ml的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1.
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2.
Ⅲ.实验数据如下表:
回答下列问题:
(1)配平化学方程式:2Al+2NaOH+2H2O$\frac{\underline{\;加热\;}}{\;}$2NaAlO2+3H2↑
(2)根据化学方程式计算样品中铝的质量分数.
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有B.
A.向锥形瓶中倒入样品时,撒出了部分粉末 B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量.
 有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.
有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.Ⅰ.取样品20g,倒入容积为200ml的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1.
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2.
Ⅲ.实验数据如下表:
| 反应前总质量m1 | 反应后总质量m2 |
| 371.84g | 371.24g |
(1)配平化学方程式:2Al+2NaOH+2H2O$\frac{\underline{\;加热\;}}{\;}$2NaAlO2+3H2↑
(2)根据化学方程式计算样品中铝的质量分数.
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有B.
A.向锥形瓶中倒入样品时,撒出了部分粉末 B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量.
13.在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降,这种物质可能是( )
| A. | 氯化钠 | B. | 硝酸铵 | C. | 氢氧化钠 | D. | 蔗糖 |
