题目内容
4. 从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:
从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中.将100g稀盐酸分5次加入烧杯中.测得烧杯中物质的质量变化如下表所示:| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
(2)求铝片中铝单质的质量分数(写出计算过程,结果保留小数点后一位)
(3)在如图中画出生成H2的质量与所加稀盐酸的质量关系.
(4)已被氧化的铝占未被氧化前铝片的质量分数是50%.
分析 氧化铝和稀盐酸反应生成氯化铝和水,铝和稀盐酸反应生成氯化铝和氢气,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)第5次加入稀盐酸时,稀盐酸过量,因此烧杯中的溶质是反应生成的氯化铝和过量的氯化氢.
故填:AlCl3、HCl.
(2)设样品中含有Al的质量为x,
由表中数据可知,反应生成氢气的质量是:20g×4+6g-85.8g=0.2g,
2Al+6HCl═2AlCl3+3H2↑,
54 6
x 0.2g
$\frac{54}{6}=\frac{x}{0.2g}$,
x=1.8g,
所以样品中Al的质量分数为:$\frac{1.8g}{6g}×100%$=30.0%,
答:样品中Al的质量分数是30.0%.
(3)由表中数据可知,当第3次进入稀盐酸时,稀盐酸才和铝反应生成氢气,加入80g稀盐酸时铝已经完全反应生成了0.2g氢气,生成H2的质量与所加稀盐酸的质量关系如下图所示:
(4)第3次实验中,20g稀盐酸中的氯化氢完全反应,设20g稀盐酸中氯化氢质量为y,
2Al+6HCl═2AlCl3+3H2↑,
219 6
y 60g+6g-65.9g
$\frac{219}{y}$=$\frac{6}{60g+6g-65.9g}$,
y=3.65g,
稀盐酸的质量分数为:$\frac{3.65g}{20g}$×100%=18.25%,
设氧化铝质量为z,
Al2O3+6HCl═2AlCl3+3H2O,
102 219
z 40g×18.25%
$\frac{102}{z}$=$\frac{219}{40g×18.25%}$,
z=3.4g,
3.4g氧化铝中铝元素质量为:3.4g×$\frac{54}{102}$×100%=1.8g,
已被氧化的铝占未被氧化前铝片的质量分数是:$\frac{1.8g}{1.8g+1.8g}$×100%=50%,
故填:50%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
| 实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
| Ⅰ | 16.0 | 60.0 | 0.5 |
| Ⅱ | 16.0 | 130.0 | 1.0 |
| Ⅲ | 16.0 | 150.0 | 1.0 |
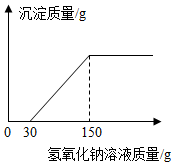
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示.计算盐酸的质量分数.(写出计算过程)
 有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.
有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.Ⅰ.取样品20g,倒入容积为200ml的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1.
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2.
Ⅲ.实验数据如下表:
| 反应前总质量m1 | 反应后总质量m2 |
| 371.84g | 371.24g |
(1)配平化学方程式:2Al+2NaOH+2H2O$\frac{\underline{\;加热\;}}{\;}$2NaAlO2+3H2↑
(2)根据化学方程式计算样品中铝的质量分数.
(3)以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有B.
A.向锥形瓶中倒入样品时,撒出了部分粉末 B.在反应过程中有水蒸气逸出
C.没有等装置中氢气全部排尽就称量.
| A. | 化学反应前后由于原子个数不变,则分子个数一定不变 | |
| B. | 单质中只含一种元素,则只含一种元素的纯净物一定是单质 | |
| C. | 催化剂的特点是:加快反应速率,且质量和化学性质不变 | |
| D. | 碱溶液呈碱性,则呈碱性的溶液一定是碱溶液 |
| A. | 在紫色的石蕊溶液中通入二氧化碳气体,溶液变红,说明二氧化碳气体能与石蕊反应 | |
| B. | 在某化肥中加入碱液,无氨味,说明该化肥一定不是氮肥 | |
| C. | 高锰酸钾受热后,固体质量减少了,说明化学反应前后各物质的质量总和不相等 | |
| D. | 把铁钉放在硫酸铜溶液中,铁钉上有紫红色的铜生成,说明铁比铜活泼 |
| A. | 氯化钠 | B. | 硝酸铵 | C. | 氢氧化钠 | D. | 蔗糖 |
| A. | 分子质量增大 | B. | 分子个数增多 | C. | 分子间间隔变大 | D. | 分子体积变大 |

 才能产生28g
才能产生28g .
.