题目内容
16.通过海水提取的粗盐中含有MgCl2、CaCl2、MgSO4.以及泥沙等杂质.以下是一种制备精盐的实验方案(用于沉淀的试剂均过量).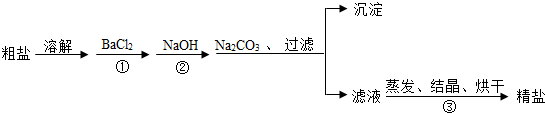
请回答下列问题:
(1)写出②中的反应方程式
(2)加入 BaCl2、NaOH、Na2CO3的顺序还可以改变吗?若能改变则写出改变的顺序,若不能改变,请说明理由.
(3)玻璃棒在操作③中的作用是什么?
(4)该实验方案还需完善,请写出具体的操作步骤.
分析 (1)根据②中的反应是氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠进行分析;
(2)根据氯化钡的作用是除去硫酸镁,氢氧化钠的作用是氯化镁,碳酸钠的作用是除去过量的氯化钡和氯化钙,碳酸钠必须放在氯化钡之后,与氢氧化钠的顺序部分先后进行分析;
(3)根据玻璃棒在操作③中的作用是搅拌,使均匀受热,防止液滴飞溅进行分析;
(4)根据过滤前的溶液中加入的碳酸钠和氢氧化钠都是过量的,反应后两者都有剩余,需要加入一种试剂将溶液中的碳酸根离子和氢氧根离子除去进行分析.
解答 解:(1)②中的反应是氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,化学方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(2)氯化钡的作用是除去硫酸镁,氢氧化钠的作用是氯化镁,碳酸钠的作用是除去过量的氯化钡和氯化钙,碳酸钠必须放在氯化钡之后,与氢氧化钠的顺序部分先后,所以改变的顺序是:BaCl2、Na2CO3、NaOH;
(3)玻璃棒在操作③中的作用是搅拌,使均匀受热,防止液滴飞溅;
(4)过滤后滤液的主要成分有:NaCl、NaOH、Na2CO3;要得到纯净的氯化钠,此实验方案尚需完善,具体步骤是:向滤液中加入适量的稀盐酸,以除去氢氧化钠和碳酸钠.
故答案为:(1)2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(2)BaCl2、Na2CO3、NaOH;
(3)搅拌,使均匀受热,防止液滴飞溅;
(4)向滤液中加入适量的稀盐酸,以除去氢氧化钠和碳酸钠.
点评 本题主要考查了粗盐提纯实验的过程,及除杂原则:在除去杂质的同时不能引入新的杂质,通过本题能很好的考查学生严密思考,分析、解决问题的能力.

练习册系列答案
相关题目
7. 2016年5月20日是第27个中国学生营养日,今年的主题是“52110,健康快乐我先行.”其中5是指中小学生每天应吃5个成年人拳头大小的蔬菜和水果,蔬菜是指煮熟或切碎的生菜叶,约300-500克,水果约200-400克,水果和蔬菜为我们提供的营养素主要是( )
2016年5月20日是第27个中国学生营养日,今年的主题是“52110,健康快乐我先行.”其中5是指中小学生每天应吃5个成年人拳头大小的蔬菜和水果,蔬菜是指煮熟或切碎的生菜叶,约300-500克,水果约200-400克,水果和蔬菜为我们提供的营养素主要是( )
 2016年5月20日是第27个中国学生营养日,今年的主题是“52110,健康快乐我先行.”其中5是指中小学生每天应吃5个成年人拳头大小的蔬菜和水果,蔬菜是指煮熟或切碎的生菜叶,约300-500克,水果约200-400克,水果和蔬菜为我们提供的营养素主要是( )
2016年5月20日是第27个中国学生营养日,今年的主题是“52110,健康快乐我先行.”其中5是指中小学生每天应吃5个成年人拳头大小的蔬菜和水果,蔬菜是指煮熟或切碎的生菜叶,约300-500克,水果约200-400克,水果和蔬菜为我们提供的营养素主要是( )| A. | 蛋白质 | B. | 糖类 | C. | 油脂 | D. | 维生素 |
4.下列相关事实用微观粒子的知识解释错误的是( )
| 选项 | 事实 | 解释 |
| A | 1滴水中约含1.67×1023个水分子 | 分子很小 |
| B | 液态水不易被压缩 | 分子间没有间隔 |
| C | 湿衣服在阳光下比在阴凉处干得快 | 温度升高,分子运动速率加快 |
| D | 氯化钠溶液能导电 | 溶液中存在自由移动的Na+和C1- |
| A. | A | B. | B | C. | C | D. | D |
1.逻辑推理是化学学习常用的思维方法,下列推理正确的是( )
| A. | 分子、原子是不带电的粒子,所以不带电的粒子一定是分子、原子 | |
| B. | 因为一氧化碳和二氧化碳的组成元素相同,所以两者的化学性质相同 | |
| C. | 化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物 | |
| D. | 氧化物都还有氧元素,所以含有氧元素的化合物都是氧化物 |

 如图是“×××钙片商品标签图”
如图是“×××钙片商品标签图”
 ,名称是硫离子.
,名称是硫离子.