题目内容
11.海水是巨大的资源宝库,利用海水为原料可获得许多化工产品.
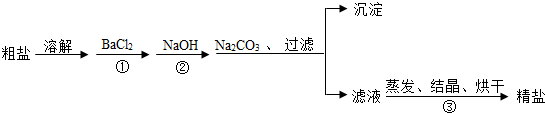
(1)如图中操作A的名称是溶解.
(2)操作B用到的玻璃仪器除了烧杯、玻璃棒外,还有漏斗.
(3)操作C中玻璃棒的作用是局部温度过高引起液滴飞溅.
(4)粗盐水中除NaCl外,还含有MgCl2、CaCl2、MgSO4等杂质.为了除掉这些杂质,需加入a组实际,它们是②NaOH溶液、②Na2CO3溶液、③BaCl2溶液(三种试剂均过量),三种试剂的添加的合理顺序为①③②(填编号).
(5)向滤液中滴加适量稀盐酸的目的是除尽过量的NaOH、Na2CO3.
分析 (1)由粗盐加水通过溶解得到粗盐水.
(2)根据过滤的原理和操作分析回答.
(3)根据在蒸发中玻璃棒的作用分析.
(4)根据粗盐中含有的杂质以及除杂质原则分析加入试剂的先后顺序.
(5)根据在除杂质时有加入过量的氢氧化钠和碳酸钠分析加入滴加适量稀盐酸的目的.
解答 解:(1)由粗盐加水通过溶解得到粗盐水.
(2)由题意可知,操作B是过滤将固液分开,用到的玻璃仪器除了烧杯、玻璃棒外,还有漏斗.
(3)由题意可知,操作C是蒸发,玻璃棒的作用是:防止局部温度过高引起液滴飞溅.
(4)在粗盐水中含有MgCl2、CaCl2、MgSO4等杂质.为了除掉这些杂质,应先加入NaOH溶液,除去镁离子,再加入BaCl2溶液,除去硫酸根离子,最后再加入Na2CO3溶液,除去钙离子和钡离子,所以,三种试剂的添加的合理顺序为:①③②.
(5)由于溶液中有与加入过量的氢氧化钠和碳酸钠,所以向滤液中滴加适量稀盐酸的目的是:除尽过量的NaOH、Na2CO3.
故答为:(1)溶解.(2)漏斗.(3)局部温度过高引起液滴飞溅.(4)①③②.(5)除尽过量的NaOH、Na2CO3.
点评 解答本题关键是要知道除杂质的方法,粗盐提纯的步骤和用到的仪器,为了能将杂质除净,应加入过量的试剂,要考虑过量的试剂应该如何除掉.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
1.下列所示实验中不能达到实验目的是( )
| A. |  验证可燃物 燃烧的条件 | |
| B. |  鉴别两种化肥: NH4Cl和KNO3 | |
| C. |  证明CO2与NaOH反应 | |
| D. |  探究呼出气体和空气中 氧气的含量不同 |
19. (1)如图是a、b、c三种物质溶解度曲线,a与c溶解度曲线相交于P点.据图回答:
(1)如图是a、b、c三种物质溶解度曲线,a与c溶解度曲线相交于P点.据图回答:
①P点的含义是t1℃时,a、b物质的溶解度相等.
②t2℃时30g a物质加入到50g水中不断搅拌,形成溶液质量是75g.
③将t2℃时a、b、c三种物质饱和溶液的温度降到t1℃时,三种溶液中溶质的质量分数由大到小的顺序排列是b>a>c
(2)将某温度下的饱和石灰水:①加入少量生石灰后恢复的原来温度;②降低温度.这两种情况下,前后均保持不变的是D.
A.溶液的质量 B.Ca(OH)2的溶解度
C.溶液中含氢氧化钙的质量 D.溶液中溶质的质量分数
(3)KNO3和KCl在不同温度时的溶解度如表所示:
由表中数据分析可知,KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值最小范围是20-30℃.
 (1)如图是a、b、c三种物质溶解度曲线,a与c溶解度曲线相交于P点.据图回答:
(1)如图是a、b、c三种物质溶解度曲线,a与c溶解度曲线相交于P点.据图回答:①P点的含义是t1℃时,a、b物质的溶解度相等.
②t2℃时30g a物质加入到50g水中不断搅拌,形成溶液质量是75g.
③将t2℃时a、b、c三种物质饱和溶液的温度降到t1℃时,三种溶液中溶质的质量分数由大到小的顺序排列是b>a>c
(2)将某温度下的饱和石灰水:①加入少量生石灰后恢复的原来温度;②降低温度.这两种情况下,前后均保持不变的是D.
A.溶液的质量 B.Ca(OH)2的溶解度
C.溶液中含氢氧化钙的质量 D.溶液中溶质的质量分数
(3)KNO3和KCl在不同温度时的溶解度如表所示:
| /℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| /g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |

 水是生命之源,它与我们的生活密切相关.
水是生命之源,它与我们的生活密切相关.