题目内容
19.氮化镁是一种应用范围非常广泛的无机化合物,它可用于制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的其它元素的氮化物,制备特殊的陶瓷材料等.某校化学研究小组用镁与氮气反应制备氮化镁(Mg3N2),并用实验方法测定氮化镁的纯度.Ⅰ:制备氮化镁
【查阅资料】
①(NH4)2SO4+2NaNO2$\frac{\underline{\;加热\;}}{\;}$2N2↑+Na2SO4+4H2O,该反应为放热反应.
②饱和硫酸亚铁溶液能吸收氧气;稀硫酸能吸收氨气.
③在常温下或温度不高的条件下镁几乎与水不反应.
【实验】
制备氮化镁的装置示意图如图甲(A-G):
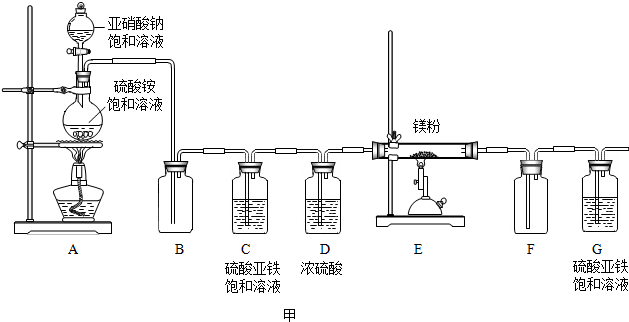
(1)D装置的作用是吸收水蒸气(或干燥氮气),G装置的作用是防止空气中氧气进入E装置.
(2)E装置中发生反应的化学方程式为3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2.
(3)实验时先进行A(选填“A”或“E”)处加热,理由是排尽装置内的空气.
Ⅱ:测定氮化镁的含量
氮化镁是浅黄色粉末,极易与水反应生成Mg(OH)2沉淀和NH3,反应的化学方程式为Mg3N2+6H2O═3Mg(OH)2+2NH3↑;,氮化镁(Mg3N2)中氮元素的化合价是-3.
【定性分析】
步骤一:取少量氮化镁样品于试管中,加足量蒸馏水,试管底部有沉淀生成,试管口闻到有刺激性气味的气体生成.
步骤二:弃去上层清液,加入稀盐酸,观察到沉淀全溶且冒气泡.该步骤中产生气泡的化学方程式为Mg+2HCl═MgCl2+H2↑.
【定量测定】
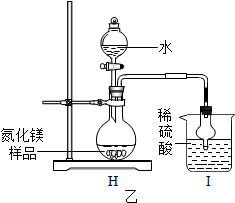
按图乙(H-I)实验装置进行实验:
(4)取氮化镁样品16g进行实验,I装置增重3.4g,求该样品中氮化镁的质量分数(请写出计算过程).
(5)球形干燥管的作用是充分反应,防止倒吸.
分析 (1)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,防止对E装置反应的影响;
(2)装置E中氮气与镁反应生成二氮化三镁;
(3)根据进行实验时先进行A处加热,为了排尽空气解答;
根据化学方程式的书写方法以及化合价的计算方法来分析;根据氮化镁水解生成氢氧化镁沉淀与氨气,氨气使湿润的红色石蕊试纸变蓝,据此设计证明有氮化镁生成;若Mg有剩余,将上述反应后的上清液去掉,加入盐酸,有气泡生成,说明有Mg剩余解答;
(4)根据I装置增重3.4克为氨气的质量,利用化学方程式分析解答;
(5)根据球形干燥管的作用是充分反应,防倒吸解答.
解答 解:(1)浓硫酸具有吸水性,能够吸收水蒸气(干燥氮气);G装置的作用是防止空气中的氧气进入E装置;D干燥氮气,除去水蒸气,防止对E装置反应的影响.故填:吸收水蒸气(或干燥氮气);防止空气中氧气进入E装置;
(2)装置E中氮气与镁反应生成二氮化三镁,反应方程式为:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2;故填:3Mg+N2$\frac{\underline{\;高温\;}}{\;}$Mg3N2;
(3)进行实验时先进行A加热,理由是排尽空气;
故填:A;排尽装置内的空气;
氮化镁与水反应生成氢氧化镁和氨气,根据在化合物中正负化合价代数和为零,则 氮化镁中氮元素的化合价为:(+2)×3+x×2=0,则x=-3,
故答案为:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑;-3;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁,反应的方程式:Mg+2HCl═MgCl2+H2↑
故填:Mg+2HCl═MgCl2+H2↑;
(4)解:设样品中氮化镁的质量为X
Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑
100 34
X 3.4g
$\frac{100}{34}$=$\frac{X}{3.4g}$
X=10g
Mg3N2的质量分数为$\frac{10g}{16g}×100%$=62.5%
答:样品中氮化镁的质量分数为62.5%.
(5)球形干燥管的作用是充分反应,防倒吸;
故填:充分反应,防止倒吸.
点评 本题以氮化镁的制备为载体,考查学生对实验装置的理解、元素化合物的性质、实验方案的设计等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.

 天天向上口算本系列答案
天天向上口算本系列答案
【查阅资料】
①碱石灰是固体氢氧化钠和氧化钙的混合物,不与氨气反应.
②氨气有刺激性气味,极易溶于水水溶液呈碱性.
【进行实验】
按如图所示连接好装置(夹持仪器略去).
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 连接好装置,关闭K1,打开K2 微热左侧双层试管 | A、C中均出现气泡 | 装置的气密性良好 |
| 打开K1,关闭K2,停止加热 | A、B烧杯中的导管内均形成一段稳定的液柱 | ||
| ② | 在试管中加入两种膨松剂,打开K1,关闭K2,点燃酒精灯加热双层试管 | 内层试管中白色固体明显减少,A、B中澄清石灰水变浑浊 | 均有二氧化碳生成 |
| ③ | 关闭K1,打开K2(开关操作) | 无色酚酞试液变红 | 有氨气生成 |
| ④ | 继续加热一段时间 | 外层试管中仍有固体 | NH4HCO3受热分解的化学方程式为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ |
| 被区分的物质 | 区分方法 | |
| A | 烧碱---纯碱 | 各取少量溶液于试管中,分别滴加酚酞试夜,观察颜色变化 |
| B | 硬水---软水 | 各取50ml分别滴加等量肥皂水,搅拌,观察产生泡沫多少 |
| C | 冰----干冰 | 各取一块置于表面皿中,观察有无白雾生成 |
| D | 生石灰---熟石灰 | 各取一药匙分别置于20ml水中,搅拌,测量温度 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 3H-3个氢元素 | B. | O2-2个氧原子 | ||
| C. | SO3-1个三氧化硫分子 | D. | $\stackrel{+3}{Fe}$-1个铁离子 |




 在用稀硫酸和氢氧化钠溶液研究中和反应实验时,某化学兴趣小组认真观察详实记录,进行了一些探究活动,请完成下列问题:
在用稀硫酸和氢氧化钠溶液研究中和反应实验时,某化学兴趣小组认真观察详实记录,进行了一些探究活动,请完成下列问题: