题目内容
10.碳酸氢钠和碳酸氢铵(NH4HCO3)是制作油条和油饼时常用的膨松剂,化学兴趣小组对这两种膨松剂受热分解后的产物进行了探究:
【查阅资料】
①碱石灰是固体氢氧化钠和氧化钙的混合物,不与氨气反应.
②氨气有刺激性气味,极易溶于水水溶液呈碱性.
【进行实验】
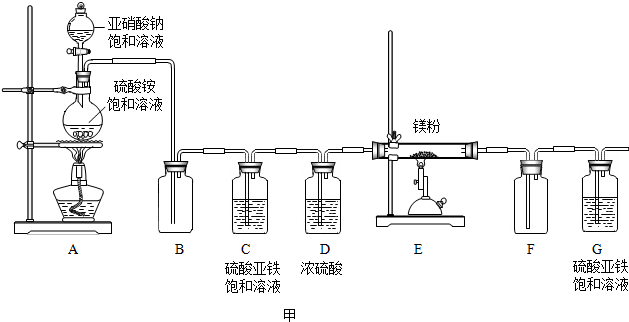
按如图所示连接好装置(夹持仪器略去).
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 连接好装置,关闭K1,打开K2 微热左侧双层试管 | A、C中均出现气泡 | 装置的气密性良好 |
| 打开K1,关闭K2,停止加热 | A、B烧杯中的导管内均形成一段稳定的液柱 | ||
| ② | 在试管中加入两种膨松剂,打开K1,关闭K2,点燃酒精灯加热双层试管 | 内层试管中白色固体明显减少,A、B中澄清石灰水变浑浊 | 均有二氧化碳生成 |
| ③ | 关闭K1,打开K2(开关操作) | 无色酚酞试液变红 | 有氨气生成 |
| ④ | 继续加热一段时间 | 外层试管中仍有固体 | NH4HCO3受热分解的化学方程式为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ |
分析 根据装置内外出现压强差,证明气密性良好,也就是C中出现气泡进行分析;
根据二氧化碳能使澄清石灰水变浑浊,氨气溶于水形成氨水,显碱性,能使酚酞变红色进行分析;
根据碳酸氢铵在加热的条件下生成氨气、水和二氧化碳进行分析;
根据碳酸氢钠完全分解后仍有固体碳酸钠,而碳酸氢铵完全分解后没有固体剩余进行分析.
解答 解:装置内外出现压强差,证明气密性良好,也就是C中出现气泡;二氧化碳能使澄清石灰水变浑浊,氨气溶于水形成氨水,显碱性,能使酚酞变红色;碳酸氢铵在加热的条件下生成氨气、水和二氧化碳,所以
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | A、C中均出现气泡 | 装置的气密性良好. | |
| 打开K1,关闭K2,停止加热. | A、B烧杯中的导管内均形成一段稳定的液柱. | ||
| ② | 在试管中加入两种膨松剂,打开K1,关闭K2,点燃酒精灯加热双层试管; | 内层试管中白色固体明显减少,A、B中澄清石灰水变浑浊, | 均有二氧化碳生成. |
| ③ | 关闭K1,打开K2;(开关操作) | 无色酚酞试液变红. | 有氨气生成. |
| ④ | 继续加热一段时间. | 外层试管中仍有固体. | NH4HCO3受热分解的化学方程式为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ |
故答案为:
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | A、C | ||
| ② | A、B中澄清石灰水变浑浊, | ||
| ③ | 关闭K1,打开K2;(开关操作) | 有氨气生成. | |
| ④ | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑ | ||
点评 根据实验的装置图及所提供资料的分析,正确理解实验的目的及出现现象的原因,对于解答此新知识的探究型问题是尤其重要的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.如图是某种粒子的结构示意图,下列根据该图分析得出的结论中,不正确的是( )
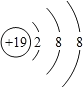

| A. | 该粒子结构属于相对稳定结构 | |
| B. | 该粒子核内有19个质子 | |
| C. | 该粒子属于阳离子 | |
| D. | 该微粒所属的元素位于元素周期表的第三周期 |
18.安徽南北各地都有一些全国知名的小吃、名菜.下列名菜、名小吃中蛋白质含量最高的是( )
| A. |  蒙城牛肉 | B. |  涡阳苔干 | C. |  泾县香菜 | D. |  黄山烧饼 |
15.紫琦过生日时发生了一件怪事,当她许下心愿吹灭蜡烛后,蜡烛竟又重新燃烧,反复几次,蜡烛总能灭而复燃.同学们将蜡烛剥开发现:在蜡烛的棉芯里藏了一根缠绕的银白色金属丝.
【提出问题】该金属丝是什么?它的存在是不是蜡烛灭而复燃的原因?
【初步探究】蜡烛为什么会灭而复燃?
【资料一】蜡烛的棉芯里藏有一些金属,当蜡烛燃烧时,棉芯里的金属被熔化的石蜡包裹起来,由于隔绝了氧气,金属并不燃烧;但当蜡烛熄灭后,金属接触到氧气就可以燃烧,从而使蜡烛复燃.
【实验反思】蜡烛燃烧产生的火焰是由气态(填“固态”或“气态”)物质燃烧产生的,紫琦认为这种蜡烛也可以熄灭,她可以采用的方法是隔绝氧气或剪除灯芯或用湿抹布盖灭.
【资料二】蜡烛内的金属是Mg、Fe或Cu中的一种.
【深入探究】这种蜡烛芯内的金属是Mg、Fe或Cu中的哪一种?
【猜想与假设】(1)根据已有的知识大家一致认为,该金属不可能是Fe和Cu,
其原因是:①铜是紫红色的,不是银白色的;②铁在空气中不能燃烧.
同学们一致猜想:该金属是Mg.
【查阅资料】镁可以与热水反应,生成氢氧化镁,温度越高,水中溶解的氢氧化镁越多.
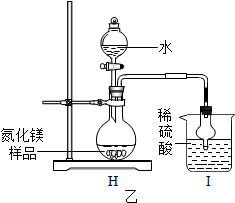
【进行实验】为了验证猜想,大家设计了如下实验:
【实验结论】此金属为镁,写出镁与热水反应的化学方程式2Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑.
【提出问题】该金属丝是什么?它的存在是不是蜡烛灭而复燃的原因?
【初步探究】蜡烛为什么会灭而复燃?
【资料一】蜡烛的棉芯里藏有一些金属,当蜡烛燃烧时,棉芯里的金属被熔化的石蜡包裹起来,由于隔绝了氧气,金属并不燃烧;但当蜡烛熄灭后,金属接触到氧气就可以燃烧,从而使蜡烛复燃.
【实验反思】蜡烛燃烧产生的火焰是由气态(填“固态”或“气态”)物质燃烧产生的,紫琦认为这种蜡烛也可以熄灭,她可以采用的方法是隔绝氧气或剪除灯芯或用湿抹布盖灭.
【资料二】蜡烛内的金属是Mg、Fe或Cu中的一种.
【深入探究】这种蜡烛芯内的金属是Mg、Fe或Cu中的哪一种?
【猜想与假设】(1)根据已有的知识大家一致认为,该金属不可能是Fe和Cu,
其原因是:①铜是紫红色的,不是银白色的;②铁在空气中不能燃烧.
同学们一致猜想:该金属是Mg.
【查阅资料】镁可以与热水反应,生成氢氧化镁,温度越高,水中溶解的氢氧化镁越多.
【进行实验】为了验证猜想,大家设计了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 将该金属丝用砂纸打磨至光亮,加入到装有热水的试管中,并将燃着的小木条放在试管口 | 有气泡不断冒出,气体燃烧,听见爆鸣声,火焰呈淡蓝色 | 生成的气体为_H2 (填化学式) |
| 在反应后的溶液中滴加酚酞溶液 | 溶液变成红色,冷却后红色褪去 | 反应生成了Mg(OH)2,滴加酚酞溶液,溶液变为红色,说明溶液显碱 性 |
2.“加多宝凉茶”、“百事可乐”、“神农谷矿泉水”等这些生活中常见的饮料属于( )
| A. | 酸 | B. | 盐 | C. | 氧化物 | D. | 混合物 |
20.工业中制备KClO3的流程如下:

已知常温下几种物质的溶解度分别为:Ca(ClO3)2 是209.0g;KClO3 是7.4g;CaCl2 是74.5g;则下列说法中错误的是( )

已知常温下几种物质的溶解度分别为:Ca(ClO3)2 是209.0g;KClO3 是7.4g;CaCl2 是74.5g;则下列说法中错误的是( )
| A. | 上述流程中氯元素化合价既有升高,又有降低 | |
| B. | 过滤操作中需要的玻璃仪器有:漏斗、烧杯、玻璃棒、酒精灯 | |
| C. | 洗涤KClO3晶体时用饱和KCl溶液比用饱和KClO3溶液效果更好 | |
| D. | 上述流程中生成KClO3的反应是:2KCl+Ca(ClO3)2=2KClO3↓+CaCl2 |