题目内容
2.有一种神奇的蜡烛,点燃后任你怎么吹也吹不灭,而且看上去和普通的蜡烛一模一样,到底是什么玄机能让蜡烛持续燃烧?请你一起参与探究.【查阅资料】1.普通蜡烛由石蜡和蜡烛芯制成的,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末.打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃.当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃.2.铝表面常有致密氧化膜,在空气中不易点燃.
【探究与反思】这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?蜡烛烛芯被石蜡蒸汽包围着,缺少氧气,里面的金属难以燃烧,这种蜡烛也可以熄灭,你采用的方法是隔绝氧气或剪除灯芯或用湿抹布盖灭等.
【实验探究】吹不灭的蜡烛芯内的金属可能是镁、铝、铁或铜中的一种,为确定该金属的成分,请你继续探究并完成下列有关问题:(注:不考虑打火石中稀土元素对探究金属性质的影响)
| 实验 | 操作步骤 | 现象 | 结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石是银白色 | 该金属一定不是铜 |
| 2 | 取少量打磨后的打火石于试管中,滴加稀盐酸 | 金属溶解,有无色气体产生,溶液为无色 | 该金属一定不是铁 |
| 3 | 取少量打磨后的打火石于试管中,滴加适量硫酸铜溶液. | 有红色物质析出,溶液由蓝色变无色 | 该金属一定是镁 |
(1)请写出“实验3”中可能涉及到的化学方程式Mg+CuSO4=MgSO4+Cu或2Al+3CuSO4=Al2(SO4)3+3Cu.
(2)有同学认为通过“实验3”中现象不能证明烛芯内的金属一定是镁,因为铝也能与硫酸铜溶液反应,也有红色固体析出.
(3)针对以上实验,请你设计一个合理的实验方案来进一步验证这种金属.
| 操作步骤 | 现象 | 结论 |
| 取少量打火石打磨后加入氯化铝溶液 | 有固体析出 | 这种金属是镁 |
分析 探究与反思:从题干信息对打火石的成分是合金进行分析,利用燃烧的条件判断灭火的方法.
实验探究:根据铜的颜色确定打火石是否属于铜,由于氯化亚铁的溶液是浅绿色的,所以采用打火石与盐酸的反应对反应后的溶液进行识别,溶液无色即为不是氯化亚铁的溶液.
分析思考:依据金属与盐溶液反应的规律:活动性排在前面的金属可以把后面的金属从其盐溶液中置换出来进行分析判断即可.
解答 解:探究与反思:利用燃烧的条件可知灯芯金属不燃烧是因为蜡蒸气起到了隔绝空气的作用,要想使其熄灭可控制燃烧的条件完成;
实验探究:打火石是银白色,而铜是紫红色的,所以该金属一定不是铜;根据氯化亚铁的溶液是浅绿色的事实分析可知:取灯芯加入盐酸如果生成无色的溶液则说明有没有铁存在;
分析思考:依据金属与盐溶液反应的规律是活动性强的金属可以从盐溶液中置换出活动性比它弱的金属分析可知:实验3中可能会发生Mg+CuSO4=MgSO4+Cu 也可能发生2Al+3CuSO4=Al2(SO4)3+3Cu,由于镁、铝、铜三种金属中铜的活动性最弱,所以镁与铝都可以置换出硫酸铜中的铜,因此不能证明该金属一定是镁也可能是铝,要想进一步判断可取少量打火石打磨后加入氯化铝溶液如有固体析出,则是镁,反之则是铝.或采用取剪除灯芯,在空气中点燃这种金属,发出耀眼的白光的是镁,不能点燃的是铝.
故答案为:
【探究与反思】蜡烛烛芯被石蜡蒸汽包围着,缺少氧气,里面的金属难以燃烧(只需答出“隔绝了氧气”或是“氧气不足”等意思即可);隔绝氧气或剪除灯芯或用湿抹布盖灭等;
【实验探究】实验1结论:该金属一定不是铜;
实验2操作步骤:取少量打磨后的打火石于试管中,滴加稀盐酸.
实验2现象:为无色.
【分析思考】
(1)Mg+CuSO4=MgSO4+Cu或2Al+3CuSO4=Al2(SO4)3+3Cu;
(2)铝也能与硫酸铜溶液反应,也有红色固体析出;
(3)取少量打火石打磨后加入氯化铝溶液如有固体析出,则是镁,反之则是铝.(或剪除灯芯,在空气中点燃这种金属,发出耀眼的白光的是镁,不能点燃的是铝.)
点评 此题是一道实验探究题,解题的关键是结合所学知识对个过程进行分析,从而设计正确的方法从而得到相应的结论.

 阅读快车系列答案
阅读快车系列答案| A. | 16:9 | B. | 23:9 | C. | 32:9 | D. | 46:9 |
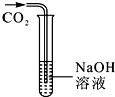 化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.
化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.探究一:二氧化碳是否与氢氧化钠发生了化学反应?
将二氧化碳通入盛有氢氧化钠溶液的大试管(如图).取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到有气泡产生,证明二氧化碳与氢氧化钠发生了反应;
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】小明认为溶质是Na2CO3;小刚认为溶质是Na2CO3和NaOH;
【查阅资料】CaCl2溶液呈中性;
【实验验证】
小刚为了验证自己的猜想,进行了如下实验,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量试管中的溶液于试管中,加入足量CaCl2溶液,过滤;②向滤液中滴加适量酚酞试液 | 酚酞试液变红 | 小刚猜想成立 |
【实验拓展】同学们联想到氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否发生,由同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴加边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7时”才可证明发生反应了,其原因是pH小于或等于7时,表明OH-被消耗,说明酸碱发生了反应;
(注意:若答对以下小题将奖励4分,但全卷总分不超过60分)
【总结提高】试设计两种不同方案证明氢氧化钠和稀硫酸确实发生了反应,从实验操作、实验现象和实验结论等方面加以说明.
| 实验操作 | 实验现象 | 实验结论 | |
| 方案一 | 氢氧化钠和稀硫酸发生了反应 | ||
| 方案二 |
| A. | 加明矾,使海水中的盐分沉淀并淡化 | |
| B. | 利用太阳能,将海水蒸馏淡化 | |
| C. | 将海水通过离子交换树脂,以除去所含的盐分 | |
| D. | 利用半透膜,采用反渗透法而使海水淡化 |
(1)提出假设:假设①白色粉末是碳酸钠
假设②白色粉末是氧化钙
假设③白色粉末是氢氧化钙
(2)设计实验,通过实验分析进行判断并填空:
| 假设 | 设计的相关实验操作 | 实验中观察到的现象 | 假设是否成立 |
| ① | 取一定量粉末加入稀盐酸 | 没有气体产生 | 不成立 |
| ② | 取一定量粉末溶于水 | 溶液浑浊且温度升高 | 成立 |
| ③ | 取一定量粉末溶于水,静置后取上层清液再通人二氧化碳 | 没有沉淀产生 | 不成立 |
 某化学兴趣小组的同学将一枚洁净的铁钉放入食盐水中(如图所示,装置气密性良好).一段时间后,进行观察.请你一起参与分析,并完成后续实验设计.
某化学兴趣小组的同学将一枚洁净的铁钉放入食盐水中(如图所示,装置气密性良好).一段时间后,进行观察.请你一起参与分析,并完成后续实验设计.[观察现象]①装置中右侧导管中的液面升高.
②铁钉生锈,试管底部有黑色固体物质.
[提出问题]导管中液面为何升高?黑色固体物质又是什么?
[理论分析]小组同学根据已学习过的知识分析得知,液面上升的原因是铁钉生锈消耗了试管内的氧气,使试管内压强低于大气压.
[猜想与假设]小组中的小明同学猜测该黑色固体可能含有:①Fe、②Fe3O4、③FeCl3、④C四种物质.
[分析与验证]小组同学根据小明的四种猜测做了以下分析:
(1)小强同学认为一定含有碳,该结论也得到小组同学的认可,理由是铁钉是铁合金,含有碳.
(2)小组同学不能确定是否含有铁,请你帮他们设计方案进行确认:
| 实验步骤 | 实验现象 | 实验结论 |
| 你选用的试剂是: |
 某探究小组的同学用如图所示实验装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应.
某探究小组的同学用如图所示实验装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应.(1)关闭K,通入二氧化碳,A、B中均无明显变化.继续通入二氧化碳.B中反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O. 从而证明了二氧化碳与氢氧化钠,氢氧化钙都能发生反应.
(2)同学们把(1)实验中反应后的A和B混合、过滤,并对滤液中的溶质成分进行探究.
【作出猜想】猜想一:NaOH
猜想二:Na2CO3和NaOH
猜想三:Ca(OH)2和NaOH
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取滤液少许于管中,滴加Na2CO3溶液 | 无明显现象 | 猜想 三不成立 |
| ②重新取滤液少许于管中,滴入过量 氯化钙溶液,在滴入2~3滴无色酚酞 | 有白色沉淀生成,溶液变红色 | 猜想二成立 |
①有同学认为上述实验中,关闭时对二氧化碳通入的量要有一定的要求,否则不足以证明二氧化碳与氢氧化钠发生了反应,原因是二氧化碳能溶于水.
②还有同学认为上述猜想不完整,还有猜想四碳酸钠.
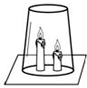 如图所示,将两支燃着的蜡烛罩上茶杯.试回答下列问题:
如图所示,将两支燃着的蜡烛罩上茶杯.试回答下列问题: