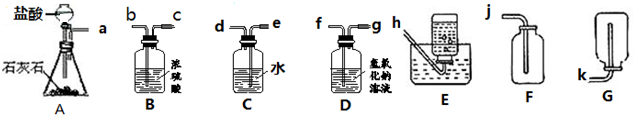
题目内容
13.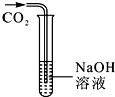 化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.
化学反应也有“悄悄”进行的.小明和他的同学对二氧化碳与氢氧化钠溶液的反应进行了如下探究.探究一:二氧化碳是否与氢氧化钠发生了化学反应?
将二氧化碳通入盛有氢氧化钠溶液的大试管(如图).取少量大试管中的液体于另一支试管中,滴加足量的稀盐酸,观察到有气泡产生,证明二氧化碳与氢氧化钠发生了反应;
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】小明认为溶质是Na2CO3;小刚认为溶质是Na2CO3和NaOH;
【查阅资料】CaCl2溶液呈中性;
【实验验证】
小刚为了验证自己的猜想,进行了如下实验,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量试管中的溶液于试管中,加入足量CaCl2溶液,过滤;②向滤液中滴加适量酚酞试液 | 酚酞试液变红 | 小刚猜想成立 |
【实验拓展】同学们联想到氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否发生,由同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴加边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7时”才可证明发生反应了,其原因是pH小于或等于7时,表明OH-被消耗,说明酸碱发生了反应;
(注意:若答对以下小题将奖励4分,但全卷总分不超过60分)
【总结提高】试设计两种不同方案证明氢氧化钠和稀硫酸确实发生了反应,从实验操作、实验现象和实验结论等方面加以说明.
| 实验操作 | 实验现象 | 实验结论 | |
| 方案一 | 氢氧化钠和稀硫酸发生了反应 | ||
| 方案二 |
分析 探究一:据氢氧化钠变质会变成碳酸钠,碳酸钠与盐酸反应会产生二氧化碳气体分析;
探究二:【实验验证】既然小刚的猜想正确,说明溶液中含有碳酸钠和氢氧化钠;溶液中加入足量氯化钙溶液后,其中的碳酸钠与氯化钙反应产生了碳酸钙沉淀和氯化钠,过滤后再滴加酚酞,由于存在氢氧化钠,溶液会变成红色;
【实验反思】根据二氧化碳与氢氧化钠反应生成碳酸钠和水写出反应的方程式;
【实验拓展】根据硫酸和氢氧化钠溶液的pH值来完成解答;
【总结提高】根据反应时溶液的酸碱性变化或能量变化等设计实验.
解答 解:探究一:由题意知,氢氧化钠已变质,氢氧化钠变质会变成碳酸钠,碳酸钠与盐酸反应会产生二氧化碳气体,故滴加足量的稀盐酸,观察到有气泡冒出;故填:有气泡产生;
探究二:【实验验证】小刚的猜想正确,说明溶液中含有碳酸钠和氢氧化钠;溶液中加入足量氯化钙溶液后,其中的碳酸钠与氯化钙反应产生了碳酸钙沉淀和氯化钠,过滤后再滴加酚酞,由于存在氢氧化钠,溶液会变成红色;故填:酚酞试液;酚酞试液变红;
【实验反思】二氧化碳与氢氧化钠反应生成碳酸钠和水;故填:CO2+2NaOH=Na2CO3+H2O;
【实验拓展】加入稀硫酸也会导致氢氧化钠溶液变稀,而使溶液的pH值变小,所以判断氢氧化钠和稀硫酸反应的现象应该是溶液的pH值小于7或等于7,表明OH-被消耗,说明酸碱发生了反应;故填:pH小于或等于7时,表明OH-被消耗,说明酸碱发生了反应;
【总结提高】由于酚酞试液遇到碱性溶液会变成红色,而在中性或酸性溶液中表现为无色,因此可以利用酚酞试液来证明二者的反应或酸碱中和反应会放热,利用温度计测定反应前后溶液温度的变化也能说明酸碱反应;故答案为(合理即可):
| 实验操作 | 实验现象 | 实验结论 | |
| 方案一 | 在氢氧化钠溶液中滴加1~2滴酚酞试液,再向其中滴加稀硫酸 | 酚酞试液由红色变为无色 | 氢氧化钠和稀硫酸发生了反应. |
| 方案二 | 在常温的氢氧化钠溶液中滴加同温稀硫酸,用温度计测量混合液的温度 | 混合液温度明显升高 |
点评 此题在以往对中和反应探究考查的基础上又有所拓展,从定量研究的角度对同学们提出了要求,在检验氢氧化钠是否是部分变质与检验是否变质是有区别的,检验变质只需用盐酸就可以了,而检验部分变质,还要检验是否有氢氧化钠,常用氯化钙溶液或是氯化钡溶液来进行检验.

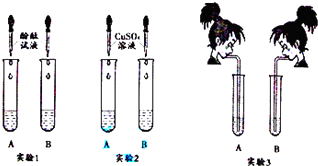
(1)实验l 中,两支试管的溶液都变成红 色.
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为2NaOH+CuSO4═Cu(OH)2↓+Na2SO4,该反应的基本类型是复分解 反应.
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式 为Ca(OH)2+CO2═CaCO3↓+H2O.B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究.
提出猜想:
猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠
产物中出现碳酸钠的原因:化学方程式表示2NaOH+CO2═Na2CO3+H2O
实验和结论:
| 实验 | 实验现象 | 结论 |
| 取B 中少量溶液,加人澄清石灰水至不再 产生沉淀为止,过滤后取上层清液, 向其中加几滴酚酞试液. | 产生白色沉淀 溶液呈现红色 | 猜想3成立 |
老师评价李红得出的结论不正确,是因为猜想2 (填数字)也会产生相同的现象.如果要验证“猜想3成立”,必须要换试剂,将Ca(OH)2换成CaCl2溶液.
【查阅资料】1.普通蜡烛由石蜡和蜡烛芯制成的,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末.打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃.当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃.2.铝表面常有致密氧化膜,在空气中不易点燃.
【探究与反思】这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?蜡烛烛芯被石蜡蒸汽包围着,缺少氧气,里面的金属难以燃烧,这种蜡烛也可以熄灭,你采用的方法是隔绝氧气或剪除灯芯或用湿抹布盖灭等.
【实验探究】吹不灭的蜡烛芯内的金属可能是镁、铝、铁或铜中的一种,为确定该金属的成分,请你继续探究并完成下列有关问题:(注:不考虑打火石中稀土元素对探究金属性质的影响)
| 实验 | 操作步骤 | 现象 | 结论 |
| 1 | 切开蜡烛,取出打火石,用砂纸打磨 | 打火石是银白色 | 该金属一定不是铜 |
| 2 | 取少量打磨后的打火石于试管中,滴加稀盐酸 | 金属溶解,有无色气体产生,溶液为无色 | 该金属一定不是铁 |
| 3 | 取少量打磨后的打火石于试管中,滴加适量硫酸铜溶液. | 有红色物质析出,溶液由蓝色变无色 | 该金属一定是镁 |
(1)请写出“实验3”中可能涉及到的化学方程式Mg+CuSO4=MgSO4+Cu或2Al+3CuSO4=Al2(SO4)3+3Cu.
(2)有同学认为通过“实验3”中现象不能证明烛芯内的金属一定是镁,因为铝也能与硫酸铜溶液反应,也有红色固体析出.
(3)针对以上实验,请你设计一个合理的实验方案来进一步验证这种金属.
| 操作步骤 | 现象 | 结论 |
| 取少量打火石打磨后加入氯化铝溶液 | 有固体析出 | 这种金属是镁 |
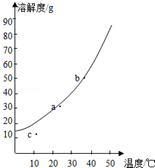 硝酸钾溶解度随温度变化的曲线如图所示:
硝酸钾溶解度随温度变化的曲线如图所示: