题目内容
16.向100g3.65%的盐酸中逐滴加入4%的氢氧化钠溶液至200g,测得盐酸的质量分数与加入的氢氧化钠溶液质量的关系如图2所示,计算回答: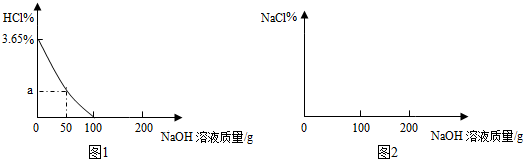
(1)据图1分析:加入氢氧化钠溶液100g时与100g稀盐酸恰好完全反应.
(2)计算坐标中a点相应的值是多少?(写出计算过程,保留小数点后两位).
(3)请在如图2的坐标图中描绘出“往盐酸中加入氢氧化钠溶液至200g”的变化曲线(要求:在坐标轴上标出主要的相关点数据)
分析 氢氧化钠和稀盐酸反应生成氯化钠和水,根据反应的化学方程式和提供的数据可以进行相关方密度计算和判断.
解答 解:(1)据图1分析:加入氢氧化钠溶液100g时与100g稀盐酸恰好完全反应.
故填:100.
(2)设加入50g氢氧化钠溶液时,反应的氯化氢质量为m,
HCl+NaOH=NaCl+H2O,
36.5 40
m 50g×4%
$\frac{36.5}{40}=\frac{m}{50g×4%}$
m=1.825g,
坐标中a点相应的值是:$\frac{3.65g-1.825g}{100g+50g}$×100%=1.22%,
答:坐标中a点相应的值是1.22%.
(3)当加入氢氧化钠溶液100g时,生成氯化钠的质量为x
HCl+NaOH=NaCl+H2O
40 58.5
4g x
$\frac{40}{58.5}=\frac{4g}{x}$
x=5.85g
氯化钠的质量分数为:$\frac{5.85g}{100g+100g}×100%$≈2.93%;
当加入氢氧化钠溶液200g时,氯化钠的质量分数为:$\frac{5.85g}{100g+200g}×100%$=1.95%;
故往盐酸中加入氢氧化钠溶液至200g”的变化曲线如下图所示: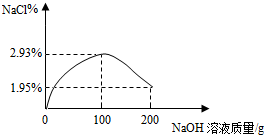
点评 本题是借助于数学模型,利用公式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力.

练习册系列答案
相关题目
6.二甲醚(C2H6O)以其无污染、易于制造的特征,可能成为一种全新的替代能源而普及.有关二甲醚的叙述正确的是( )
| A. | 二甲醚由9个原子构成 | |
| B. | 二甲醚中碳、氢、氧三种元素的质量比为2﹕6﹕1 | |
| C. | 2.3 g二甲醚中含碳元素的质量为1.2 g | |
| D. | 二甲醚和甲烷在氧气中完全燃烧的产物不相同 |
7.下列实验操作或设计,合理的是( )
| A. |  验证质量守恒定律 | B. |  检查装置的气密性 | ||
| C. |  过滤食盐水获得食盐 | D. |  电解水测定水的组成 |
4.下物质保存方法的原因正确的是( )
| 选项 | 保存方法 | 原 因 |
| A | 生石灰应密封保存 | 生石灰易与空气中的氧气反应 |
| B | 浓盐酸应密封保存 | 浓盐酸在空气中易分解 |
| C | 烧碱应密封保存 | 烧碱易潮解且与空气中二氧化碳反应 |
| D | 白磷应保存在水中 | 白磷有剧毒 |
| A. | A | B. | B | C. | C | D. | D |
11.据报道,最近科学家人工合成了硬度超越钻石的纳米等级的立方氮化硼,制造出了新一代世界上最硬的物质.下列有关该物质说法不正确的是( )
| A. | 可用于钻探 | B. | 属于有机合成材料 | ||
| C. | 可用于机械加工 | D. | 可用于刻划玻璃 |
1.大气中 CO2的产生途径是( )
①燃料燃烧②光合作用③动植物呼吸④微生物分解作用.
①燃料燃烧②光合作用③动植物呼吸④微生物分解作用.
| A. | ①②③ | B. | ①③④ | C. | ①②④ | D. | ②③④ |
8.下列变化中,前者属于化学变化,后者属于物理变化的是( )
| A. | 呼吸作用光合作用 | B. | 煤气燃烧石油蒸馏 | ||
| C. | 风力发电木炭吸附 | D. | 海水晒盐干冰升华 |
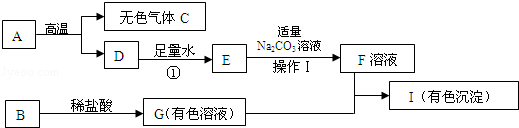
6.碳酸钠用途非常广泛,重要的化工原料.我国科学家侯德榜于1921 年创造了著名的“联合制碱法”,并在天津塘沽兴建了中国最早的制碱厂“永利制碱厂”.其主要生产过程如下:
(1)首先制取碳酸氢铵:NH3+CO2+H2O=NH4HCO3,该反应的基本反应类型为化合反应.
(2)第二步是用食盐与NH4HCO3反应.原料食盐来源于的渤海湾,从海水中提取粗盐.该粗盐主要含有氯化钠,还含有少量的氯化钙、氯化镁和硫酸钠.为得到纯净的食盐水将粗盐水进行如下净化过程:
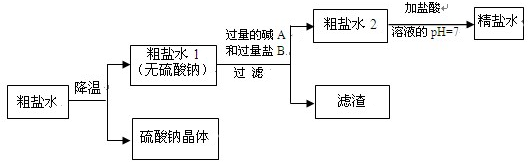
①从粗盐水中析出硫酸钠晶体其原理是降温结晶
②碱A 是由郊县的石灰石资源得到的,则过量的碱A 和粗盐水中的物质反应的方程式为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
③加入的盐B 是,滤渣中含有的物质是Mg(OH)2、CaCO3
④查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl 在30℃时的溶解度如表所示:
请根据溶解度表所提供的信息,写出该步制碱法中复分解反应的化学方程式NH4HCO3+NaCl=NaHCO3↓+NH4Cl
(3)第三步加热碳酸氢钠:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(1)首先制取碳酸氢铵:NH3+CO2+H2O=NH4HCO3,该反应的基本反应类型为化合反应.
(2)第二步是用食盐与NH4HCO3反应.原料食盐来源于的渤海湾,从海水中提取粗盐.该粗盐主要含有氯化钠,还含有少量的氯化钙、氯化镁和硫酸钠.为得到纯净的食盐水将粗盐水进行如下净化过程:

①从粗盐水中析出硫酸钠晶体其原理是降温结晶
②碱A 是由郊县的石灰石资源得到的,则过量的碱A 和粗盐水中的物质反应的方程式为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
③加入的盐B 是,滤渣中含有的物质是Mg(OH)2、CaCO3
④查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl 在30℃时的溶解度如表所示:
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步加热碳酸氢钠:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.