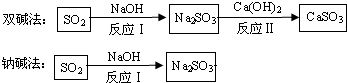
题目内容
14.化学是一门研究物质的科学,我们一般从物质的存在、性质、制备、用途等方面研究一种物质或一类物质.以金属为例,请你参与其中回答相关问题:(1)认识金属元素存在:自然界中大多数金属都以化合物的形式存在.下列矿石的主要成分属于氧化物的是ACD(填字母序号,下同);
A.铝土矿 (主要成分Al2O3) B.钾长石(主要成分KAlSi3O8)
C.赤铁矿 (主要成分Fe2O3) D.磁铁矿 (主要成分Fe3O4)
(2)探究金属性质:金属原子容易失去最外层电子,化学性质活泼.图1为探究金属化学性质的实验,图2是金属化学性质网络图.
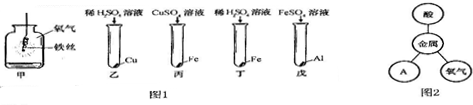
①图1甲中反应现象是剧烈燃烧,火星四射,生成黑色固体,丙中反应的化学方程式为Fe+CuSO4═FeSO4+Cu
②图1只有乙中不反应,能得出三种金属活动性及它们和氢元素的位置关系,由强到弱的顺序是Al、Fe、(H)、Cu(填元素符号);
③依据图1完成金属性质网络,图2中的A属于盐(填物质类别);
(3)认识金属的制备:工业上常采用还原法、置换法、电解法制备金属.
用一氧化碳还原赤铁矿冶铁反应的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(4)金属在生产生活中应用广泛:
①下列金属制品的用途,利用其导电性的是B
A.铁锅 B.铜导线 C.铝箔 D.黄金饰品
②合金性能优于单一金属,因而被广泛应用.焊锡(主要含锡、铅)与其组成金属相比具有熔点较低的特性,可用于焊接电子元件.
③金属是一种有限资源,需要保护和回收利用.
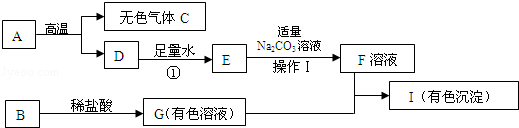
黄铜(铜锌合金)用作弹壳的制造.现有一批使用过的、锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示:
【收集资料】弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应.
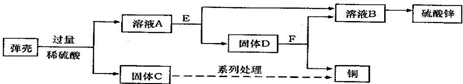
a.写出弹壳上的锈与稀硫酸反应的化学方程式Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
b.固体D为锌和铜.
分析 根据已有的知识进行分析解答,氧化物是由两种元素组成且其中一种是氧元素的化合物;根据金属的性质以及反应的现象进行分析解答,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换处理,根据合金的性质解答,根据反应化学方程式的书写方法解答即可.
解答 解:(1)A.铝土矿的主要成分Al2O3属于氧化物,B.钾长石的主要成分KAlSi3O8不属于氧化物,C.赤铁矿的主要成分Fe2O3属于氧化物,D.磁铁矿的主要成分Fe3O4属于氧化物;
(2)①图1甲中是铁在氧气中燃烧,反应现象是剧烈燃烧,火星四射,生成黑色固体,丙中反应是铁与硫酸铜反应生成硫酸亚铁和铜,其反应的化学方程式为 Fe+CuSO4═FeSO4+Cu;
②图1只有乙中不反应,说明铜在氢的后面,铁能与硫酸反应,说明铁在氢的前面,铝能与硫酸亚铁反应,说明铝在铁的前面,故能得出三种金属活动性及它们和氢元素的位置关系是铝、铁、(氢)、铜;
③金属能与酸、氧气和盐反应,故图2中的A属于盐;
(3)用一氧化碳还原赤铁矿冶铁反应是一氧化碳与氧化铁高温反应生成铁和二氧化碳,其化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(4)①铜导线利用其导电性;
②焊锡(主要含锡、铅)与其组成金属相比具有熔点较低的特性,可用于焊接电子元件.
③黄铜(铜锌合金)用作弹壳的制造.现有一批使用过的、锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如下所示:
【收集资料】弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、也不参加反应.
a.弹壳上的锈是碱式碳酸铜,能与与稀硫酸反应生成硫酸铜、水和二氧化碳,其化学方程式 Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑;
b.碱式碳酸铜与硫酸反应生成硫酸铜,硫酸铜能与锌反应生成铜,由于锌过量,故固体D为锌和铜.
故答案为:(1)ACD
(2)①剧烈燃烧,火星四射,生成黑色固体 Fe+CuSO4═FeSO4+Cu(2分)
②Al、Fe、(H)、Cu;③盐;
(3)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2(2分)
(4)①B;②熔点较低
③a、Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑(2分)
b、锌和铜.
点评 本题考查的是常见的金属的性质,完成此题,可以依据已有的金属的性质以及金属活动性顺序的意义进行.

| 选项 | 保存方法 | 原 因 |
| A | 生石灰应密封保存 | 生石灰易与空气中的氧气反应 |
| B | 浓盐酸应密封保存 | 浓盐酸在空气中易分解 |
| C | 烧碱应密封保存 | 烧碱易潮解且与空气中二氧化碳反应 |
| D | 白磷应保存在水中 | 白磷有剧毒 |
| A. | A | B. | B | C. | C | D. | D |
(1)首先制取碳酸氢铵:NH3+CO2+H2O=NH4HCO3,该反应的基本反应类型为化合反应.
(2)第二步是用食盐与NH4HCO3反应.原料食盐来源于的渤海湾,从海水中提取粗盐.该粗盐主要含有氯化钠,还含有少量的氯化钙、氯化镁和硫酸钠.为得到纯净的食盐水将粗盐水进行如下净化过程:
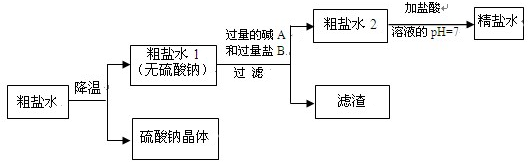
①从粗盐水中析出硫酸钠晶体其原理是降温结晶
②碱A 是由郊县的石灰石资源得到的,则过量的碱A 和粗盐水中的物质反应的方程式为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
③加入的盐B 是,滤渣中含有的物质是Mg(OH)2、CaCO3
④查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl 在30℃时的溶解度如表所示:
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步加热碳酸氢钠:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
| A. | 空气是一种宝贵的资源 | |
| B. | 氧气可用作火箭发射的燃料 | |
| C. | 相比空气,“人造空气”中的氮气含量低 | |
| D. | 燃烧和缓慢氧化都属于氧化反应 |
| A. |  读液体体积 | B. |  吸取稀盐酸 | ||
| C. |  熄灭酒精灯 | D. |  向试管中装入锌粒 |
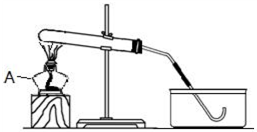 如图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图,请回答下列问题:
如图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图,请回答下列问题: