题目内容
17.下列对有关实验异常现象分析合理的是( )| A. | 铁丝在氧气中燃烧时集气瓶瓶底炸裂--红热的铁丝碰到集气瓶内壁 | |
| B. | 向澄清石灰水中通入二氧化碳无明显现象--可能是二氧化碳中混有氯化氢气体 | |
| C. | 将表面未处理的铝丝插入硫酸铜溶液中无明显现象--铝的金属活动性比铜弱 | |
| D. | 在粗盐提纯实验中过滤速率过慢--没用玻璃棒引流 |
分析 A、根据铁丝在氧气中燃烧的注意事项,进行分析判断.
B、根据氯化氢气体能与石灰水反应生成氯化钙和水,进行分析判断.
C、根据未处理的铝丝表面有一层致密的氧化铝薄膜,进行分析判断.
D、根据过滤操作的注意事项,进行分析判断.
解答 解:A、铁丝在氧气中燃烧时集气瓶瓶底炸裂,可能是集气瓶的底部应放少量的水或铺一层细沙,故选项说法错误.
B、向澄清石灰水中通入二氧化碳无明显现象,可能是二氧化碳中混有氯化氢气体,氯化氢气体与石灰水反应生成氯化钙和水,故选项说法正确.
C、未处理的铝丝表面有一层致密的氧化铝薄膜,会阻碍反应的进行,插入硫酸铜溶液中无明显现象,不能说明铝的金属活动性比铜弱,故选项说法错误.
D、是否用玻璃棒引流与过滤速率的快慢无关,故选项说法错误.
故选:B.
点评 本题难度不大,掌握金属的化学性质、氯化氢的化学性质、过滤操作的注意事项等是正确解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列实验操作或设计,合理的是( )
| A. |  验证质量守恒定律 | B. |  检查装置的气密性 | ||
| C. |  过滤食盐水获得食盐 | D. |  电解水测定水的组成 |
8.下列变化中,前者属于化学变化,后者属于物理变化的是( )
| A. | 呼吸作用光合作用 | B. | 煤气燃烧石油蒸馏 | ||
| C. | 风力发电木炭吸附 | D. | 海水晒盐干冰升华 |
6.碳酸钠用途非常广泛,重要的化工原料.我国科学家侯德榜于1921 年创造了著名的“联合制碱法”,并在天津塘沽兴建了中国最早的制碱厂“永利制碱厂”.其主要生产过程如下:
(1)首先制取碳酸氢铵:NH3+CO2+H2O=NH4HCO3,该反应的基本反应类型为化合反应.
(2)第二步是用食盐与NH4HCO3反应.原料食盐来源于的渤海湾,从海水中提取粗盐.该粗盐主要含有氯化钠,还含有少量的氯化钙、氯化镁和硫酸钠.为得到纯净的食盐水将粗盐水进行如下净化过程:
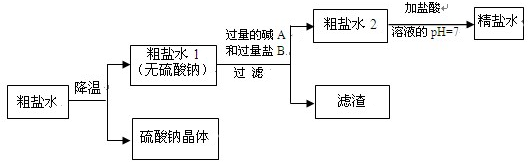
①从粗盐水中析出硫酸钠晶体其原理是降温结晶
②碱A 是由郊县的石灰石资源得到的,则过量的碱A 和粗盐水中的物质反应的方程式为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
③加入的盐B 是,滤渣中含有的物质是Mg(OH)2、CaCO3
④查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl 在30℃时的溶解度如表所示:
请根据溶解度表所提供的信息,写出该步制碱法中复分解反应的化学方程式NH4HCO3+NaCl=NaHCO3↓+NH4Cl
(3)第三步加热碳酸氢钠:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(1)首先制取碳酸氢铵:NH3+CO2+H2O=NH4HCO3,该反应的基本反应类型为化合反应.
(2)第二步是用食盐与NH4HCO3反应.原料食盐来源于的渤海湾,从海水中提取粗盐.该粗盐主要含有氯化钠,还含有少量的氯化钙、氯化镁和硫酸钠.为得到纯净的食盐水将粗盐水进行如下净化过程:

①从粗盐水中析出硫酸钠晶体其原理是降温结晶
②碱A 是由郊县的石灰石资源得到的,则过量的碱A 和粗盐水中的物质反应的方程式为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
③加入的盐B 是,滤渣中含有的物质是Mg(OH)2、CaCO3
④查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl 在30℃时的溶解度如表所示:
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步加热碳酸氢钠:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
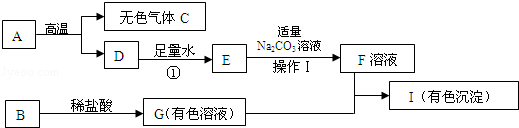
 A、B、C 三种物质的转化关系如图所示:
A、B、C 三种物质的转化关系如图所示: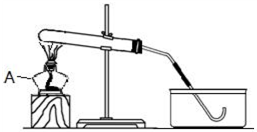 如图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图,请回答下列问题:
如图是某同学正在绘制的实验室用高锰酸钾制取氧气的装置图,请回答下列问题: