题目内容
实验室用过氧化氢溶液制氧气,在过氧化氢溶液88.5g中加入1g二氧化锰,完全反应后称得剩余物的质量为87.9g,求:
(1)反应中放出氧气的质量.
(2)过氧化氢溶液中过氧化氢的质量分数.(计算结果保留到小数点后一位)
(1)反应中放出氧气的质量.
(2)过氧化氢溶液中过氧化氢的质量分数.(计算结果保留到小数点后一位)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:首先根据物质的总质量的减少得出生成的气体的质量,然后把生成的气体的质量代入化学方程式进行计算.
解答:解:
(1)氧气的质量:88.5g+1g-87.9g=1.6g
(2)设:过氧化氢溶液中过氧化氢的质量为x
2H2O2
2H2O+O2↑
68 32
x 1.6g
=
x=3.4g
故实验中加入的过氧化氢溶液中过氧化氢的质量分数=
×100%≈3.8%
答案:
(1)反应中放出氧气的质量1.6g
(2)过氧化氢溶液中过氧化氢的质量分数3.8%
(1)氧气的质量:88.5g+1g-87.9g=1.6g
(2)设:过氧化氢溶液中过氧化氢的质量为x
2H2O2
| ||
68 32
x 1.6g
| 68 |
| x |
| 32 |
| 1.6g |
x=3.4g
故实验中加入的过氧化氢溶液中过氧化氢的质量分数=
| 3.4g |
| 88.5g |
答案:
(1)反应中放出氧气的质量1.6g
(2)过氧化氢溶液中过氧化氢的质量分数3.8%
点评:本题难度不大,主要考查了根据化学方程式来计算有关的量,从而使学生来认识化学反应的本质,代入化学方程式计算的数据必须是纯净物的质量才行.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列变化中不属于化学变化的是( )
| A、溶洞的形成 | B、物质的燃烧 |
| C、火药爆炸 | D、矿石的粉碎 |

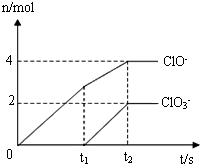 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.