题目内容
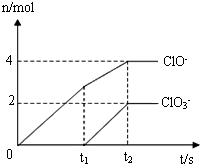 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生反应的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-离子的反应为:6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O.试回答:
(1)t2时,Ca(ClO)2与Ca(ClO3)2的物质的量之和为
(2)据分析,生成Ca(ClO3)2的反应是由温度升高引起的,通过氯气的速度不同,ClO-和ClO3-的比例也不同.若在原石灰乳中通入氯气的速度加快,则反应后
| n(ClO-) | ||
n(Cl
|
| n(ClO-) | ||
n(Cl
|
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:根据图中数据可以判断次氯酸钙和氯酸钙的物质的量之和,同时能够判断该石灰乳中含有的Ca(OH)2的质量;
根据提供的条件和信息可以判断氯离子的物质的量.
根据提供的条件和信息可以判断氯离子的物质的量.
解答:解:(1)氢氧化钙和氯气反应的化学方程式为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,
6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O,
由表中数据可知,次氯酸根离子的物质的量是4mol,说明生成的次氯酸钙的物质的量是2mol,反应的氢氧化钙的物质的量是4mol;
氯酸根离子的物质的量是2mol,说明生成的氯酸钙的物质的量是1mol,反应的氢氧化钙的物质的量是6mol,因此t2时,Ca(ClO)2与Ca(ClO3)2的物质的量之和为3mol;
氢氧化钙的物质的量是10mol,质量为:74g/mol×10mol=740g.
故填:3;740.
(2)若在原石灰乳中通入氯气的速度加快,则反应放热速率加快,温度升高得快,生成氯酸钙的速率加快,导致生成的次氯酸根离子和氯酸根离子的物质的量之比小于2;
假设n(ClO3-)=x,
则x+5x+ax+ax=20,
x=
,
n(Cl-)=
+
=
,
故填:<;
.
6Ca(OH)2+6Cl2=5CaCl2+Ca(ClO3)2+6H2O,
由表中数据可知,次氯酸根离子的物质的量是4mol,说明生成的次氯酸钙的物质的量是2mol,反应的氢氧化钙的物质的量是4mol;
氯酸根离子的物质的量是2mol,说明生成的氯酸钙的物质的量是1mol,反应的氢氧化钙的物质的量是6mol,因此t2时,Ca(ClO)2与Ca(ClO3)2的物质的量之和为3mol;
氢氧化钙的物质的量是10mol,质量为:74g/mol×10mol=740g.
故填:3;740.
(2)若在原石灰乳中通入氯气的速度加快,则反应放热速率加快,温度升高得快,生成氯酸钙的速率加快,导致生成的次氯酸根离子和氯酸根离子的物质的量之比小于2;
假设n(ClO3-)=x,
则x+5x+ax+ax=20,
x=
| 10 |
| 3+a |
n(Cl-)=
| 50 |
| 3+a |
| 10a |
| 3+a |
| 10(a+5) |
| a+3 |
故填:<;
| 10(a+5) |
| a+3 |
点评:利用图象能够直观地反映物质之间相互作用的过程,因此要学会观察实验数据,善于分析实验数据,为正确地解答问题奠定基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组物质,按化合物、混合物顺序排列的是( )
| A、食盐、干冰 |
| B、胆矾、石灰石 |
| C、红磷、烧碱 |
| D、水银、生理盐水 |



 甲、乙、丙三种固体物质的溶解度曲线如图,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图,请回答: