题目内容
4.请你结合下列装置图回答问题:
(1)写出有标号仪器的名称:a酒精灯,b锥形瓶.
(2)实验室用甲装置制氧气的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
用排水法收集氧气.反应结束后冷却,往试管中加入足量的水,搅拌、过
滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程
式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,黑色粉末在反应中的作用是催化作用.
(3)某化学兴趣小组用乙装置制取并检验二氧化碳.实验过程中,可观察到试管里产生白色沉淀,反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.产生沉淀后继续通入二氧化碳,过一段时间后,发现沉淀溶解变成澄清溶液.为了确定沉淀溶解成澄清溶液的原因,小组的同学进行了相关探究.
(提出问题):沉淀为什么能溶解变成澄清溶液?
(查阅资料):碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水.
(猜想与假设):①溶液呈酸性;②反应生成了碳酸氢钙.
(实验与结论):
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用玻璃棒蘸取沉淀溶解成澄清的溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照. | 测得被测液的pH=8 | 猜想①不成立. (填“成立”或“不成立”) |
| 实验Ⅱ:取沉淀溶解成澄清的溶液于另一支试管中,加入稀 盐酸. | 有气体产生 | 反应的化学方程式为: 2HCl+Ca(HCO3)2=CaCl2+2H2O+2CO2↑. 猜想②成立. |
(交流与反思):
从探究中你得到的启示或感受是不溶物在一定条件下可转化为可溶物.
分析 (1)熟悉常见的化学仪器,了解它们的名称;
(2)甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气;然后根据氧气不易溶于水,密度大于空气密度的特点选择收集方法;反应结束后,给冷却的试管加水过滤得到的黑色粉末是二氧化锰,它可以作为催化剂与过氧化氢溶液反应生成氧气;
(3)根据二氧化碳与澄清石灰水反应,使澄清石灰水[主要成分Ca(OH)2]变浑浊的性质判断试管内的现象,并据此写出反应式.
(实验与结论):
把一小片pH试纸放在一块干净的玻璃片上,用玻璃棒蘸取A溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照,测得被测液的pH=8,说明溶液呈碱性,因此猜想①不成立;取A溶液于另一支试管中,加入稀盐酸,有气体产生,猜想②成立;碳酸氢钙和盐酸反应生成氯化钙钙和水和二氧化碳,配平即可.从探究中得到的启示是:不溶物在一定条件下可转化为可溶物,或条件不同,产物不同等
解答 解:(1)熟悉常见的化学仪器,了解它们的名称.图中a是酒精灯,b是锥形瓶.故答案为:酒精灯;锥形瓶;
(2)甲装置是可以加热的装置,实验室中可用加热高锰酸钾的方法制取氧气.反应方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;氧气的密度大于空气的密度,并且不溶于水,我们可用排水集气法(或向上排空气法)收集;加热高锰酸钾的反应结束后,产物有K2MnO4、MnO2、O2.其中的O2被收集、K2MnO4可溶于水,在加水、搅拌、过滤后,只剩下不溶于水的黑色粉末MnO2.实验室中常用二氧化锰做催化剂,分解过氧化氢制取氧气.反应方程式是:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
故答案分别为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑、排水集气法(或向上排空气法)、2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、催化作用;
(3)乙装置中生成的二氧化碳气体,通过导管进入盛有澄清石灰水的试管,与澄清石灰水[主要成分Ca(OH)2]反应,生成白色沉淀碳酸钙.反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:白、Ca(OH)2+CO2=CaCO3↓+H2O.
(实验与结论):
实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用玻璃棒蘸取溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照,测得被测液的pH=8,说明溶液呈碱性,因此猜想①不成立,故答案为:玻璃棒; 不成立;
实验Ⅱ:取溶液于另一支试管中,加入稀盐酸,有气体产生,猜想②成立;碳酸氢钙和盐酸反应生成氯化钙钙和水和二氧化碳,配平即可,故答案为:稀盐酸;2HCl+Ca(HCO3)2=CaCl2+2H2O+2CO2↑;
从探究中你得到的启示或感受是不溶物在一定条件下可转化为可溶物.
故答案为:
(1)酒精灯;锥形瓶;
(2)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;排水法(或向上排空气法);2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;催化作用;(3)白;CO2+Ca(OH)2=CaCO3↓+H2O;
实验与结论 实验Ⅰ:玻璃棒;不成立;
实验Ⅱ:稀盐酸; 2HCl+Ca(HCO3)2=CaCl2+2H2O+2CO2↑;
交流与反思:不溶物在一定条件下可转化为可溶物(其他合理答案亦可)
点评 本题考查常见气体的制取与制取装置的选取,以及化学方程式的书写.考查知识点全面,而且是我们的常见问题.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案①金属活动性顺序:M>Cu>Ag
②滤液中一定含有M的阳离子和Cu2+
③金属M可能是Fe
④滤渣中一定含有Ag和Cu
③向滤液中滴加稀盐酸,可能产生白色沉淀
以上说法中正确的是( )
| A. | ①②④ | B. | ②③⑤ | C. | ③④⑤ | D. | ①②⑤ |
| A. | 实验室制氢气时,用铁片替代锌片 | |
| B. | 实验室制二氧化碳时,用石灰石替代大理石 | |
| C. | 采用分解过氧化氢的方法制氧气时,用KMnO4替代MnO2 | |
| D. | 用浓碳酸钠溶液和饱和石灰水制取氢氧化钠,用氢氧化钾溶液替代石灰水 |
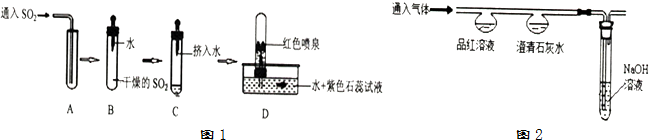
探究一:SO2的制取
(1)实验室常用固体亚硫酸钠(Na2SO3)与稀硫酸在常温下反应制取二氧化硫,选择发生装置主要应该考虑的因素是AB(填序号,可多选).
A、反应物的状态 B、反应条件 C、气体密度 D、气体溶解性
(2)探究二氧化硫性质,该兴趣小组进行了如图1所示的实验
通过上述实验,可推测SO2气体的性质有:①二氧化硫密度比空气大;②二氧化硫能溶于水.
探究二:CO2和SO2性质的比较
兴趣小组设计并进行如图2的实验,探究比较CO2和SO2的化学性质.
| 实验Ⅰ | 实验Ⅱ | |
| 通入CO2 | 通入SO2 | |
| 品红溶液 | 无明显变化 | 红色褪为无色 |
| 澄清石灰水 | 白色浑浊 | 白色浑浊 |
①二氧化硫能与澄清石灰水反应,生成亚硫酸钙(CaSO3)和水,写出该反应的化学方程式Ca(OH)2+SO2═CaSO3↓+H2O.
②鉴别CO2和SO2的方法是将气体分别通入品红溶液,红色褪去的是二氧化硫,无明显变化的是二氧化碳.
③实验Ⅱ中NaOH溶液的作用是吸收尾气,防止其污染空气.
探究三 测定空气中SO2的含量,探究小组进行如下实验
【查阅资料】①碘水遇淀粉变蓝色
②二氧化碳与碘水反应的化学方程式为:SO2+I2+2H2O═H2SO4+2HI(SO2、I2的相对分子质量分别为64.254)
③我国环境空气质量标准中对每次空气质量测定中SO2最高浓度限值
| SO2最高浓度限值(单位mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
Ⅰ.检查装置的气密性
Ⅱ.向试管中加入1g溶质质量分数为0.0127%的碘水,用适量的蒸馏水稀释,再滴入2-3滴淀粉溶液,配制成稀溶液.
Ⅲ.在指定地点用注射器抽取空气140次注入上述试管中(假设每次抽气500mL)由实验可知:
①当溶液由蓝色变成无色时反应恰好完全
②由此可计算空气中SO2的含量0.46mg/m3(结果精确至0.01),所测地点的空气中SO2的含量属于二级标准(填如表中所列举的等级).
| A.解释说明 | B.化学与生活 |
| ①稀有气体作保护气--化学性质稳定 ②O2、CO2化学性质不同--分子构成不同 ③众人拾柴火焰高--可燃物越多,燃烧越旺 | ①蛋白质、油脂、糖类都能为人体提供能量 ②人体所需维生素量不多,但不能缺少 ③玻璃钢、铝合金都是金属材料 |
| C.化学用语中数字的含义 | D.方程式表示所述内容 |
| ①H2O:一个水分子含有两个氢原子 ②$\stackrel{+2}{Ca}$:一个钙离子带有两个单位正电荷 ③$\stackrel{-2}{S}$:硫元素的化合价为负二价 | ①酸雨形成CO2+H2O═H2CO3 ②治疗胃酸过多Al(OH)3 +3HCl═AlCl3+3H2O ③铝制品耐腐的原因:4Al+3O2═2Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
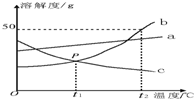 根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
 铜、铁、铝作为金属材料一直被广泛应用.
铜、铁、铝作为金属材料一直被广泛应用.