题目内容
5.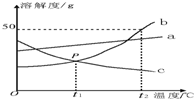 根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:(1)P点表示在t1℃两物质的溶解度关系为b=c(填“>”、“<”或“=”).
(2)t2℃,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为b>a>c.
(3)t2℃时,50g b物质加入到50g水中充分溶解后,所得溶液的质量为75g.
(4)b中含有少量的a,若要提纯b,可采用降温(或冷却热饱和溶液)结晶的方法.
(5)配制200g 5%的b物质的水溶液,需要b物质的质量为10g.
分析 (1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)饱和溶液中溶质的在分数=$\frac{溶解度}{溶解度+100g}$×100%,即溶解度大则溶质的质量分数大;
(3)据该温度下b的溶解度分析解答;
(4)据ab的溶解度受温度影响情况分析解答;
(5)据溶质的质量=溶液的质量×溶质的质量分数分析解答.
解答 解:(1)P点是t1℃两物质的溶解度曲线的交点,表示该温度下两物质的溶解度相等;
(2)t2℃,a、b、c三种物质的溶解度大小关系是:b>a>c,饱和溶液中溶解度大则溶质的质量分数大,所以饱和溶液溶质质量分数的大小关系为b>a>c;
(3)t2℃时b的溶解度是50g,即100g水中最多溶解50g的b,所以50g b物质加入到50g水中充分溶解后,剩余25g,所得溶液的质量为75g;
(4)由图可知:b的溶解度受温度影响较大,a的溶解度受温度影响较小,所以b中含有少量的a,若要提纯b,可采用 降温结晶或冷却热饱和溶液的方法;
(5)配制200g 5%的b物质的水溶液,需要b物质的质量为200g×5%=10g;
故答案为:(1)=;(2)b>a>c;(3)75 g; (4)降温(或冷却热饱和溶液); (5)10.
点评 了解溶解度概念、溶解度曲线的意义并能灵活运用解答相关问题,同时掌握溶质的质量的计算、及物质分离的方法.

练习册系列答案
相关题目
16.要善于从化学的视角认识世界.对下列事实解释错误的是( )
| A. | 50mL酒精与50mL水混合后体积小于100mL,分子之间有一定间隔 | |
| B. | 酒香不怕巷子深--分子在不断运动 | |
| C. | 水银体温计测量体温--温度升高,分子大小发生改变 | |
| D. | 一氧化碳和二氧化碳化学性质不同--分子构成不同 |
13.下列是人体中几种体液的正常 pH,酸性最强的是( )
| A. | 胆汁(6.8-7.4) | B. | 唾液(6.6-7.1) | C. | 胃液(0.8-1.5) | D. | 血液(7.35-7.45) |
4.请你结合下列装置图回答问题:

(1)写出有标号仪器的名称:a酒精灯,b锥形瓶.
(2)实验室用甲装置制氧气的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
用排水法收集氧气.反应结束后冷却,往试管中加入足量的水,搅拌、过
滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程
式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,黑色粉末在反应中的作用是催化作用.
(3)某化学兴趣小组用乙装置制取并检验二氧化碳.实验过程中,可观察到试管里产生白色沉淀,反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.产生沉淀后继续通入二氧化碳,过一段时间后,发现沉淀溶解变成澄清溶液.为了确定沉淀溶解成澄清溶液的原因,小组的同学进行了相关探究.
(提出问题):沉淀为什么能溶解变成澄清溶液?
(查阅资料):碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水.
(猜想与假设):①溶液呈酸性;②反应生成了碳酸氢钙.
(实验与结论):
通过探究得知,生成的沉淀会与二氧化碳、水反应生成了可溶于水的碳酸氢钙.
(交流与反思):
从探究中你得到的启示或感受是不溶物在一定条件下可转化为可溶物.

(1)写出有标号仪器的名称:a酒精灯,b锥形瓶.
(2)实验室用甲装置制氧气的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
用排水法收集氧气.反应结束后冷却,往试管中加入足量的水,搅拌、过
滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程
式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,黑色粉末在反应中的作用是催化作用.
(3)某化学兴趣小组用乙装置制取并检验二氧化碳.实验过程中,可观察到试管里产生白色沉淀,反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O.产生沉淀后继续通入二氧化碳,过一段时间后,发现沉淀溶解变成澄清溶液.为了确定沉淀溶解成澄清溶液的原因,小组的同学进行了相关探究.
(提出问题):沉淀为什么能溶解变成澄清溶液?
(查阅资料):碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水.
(猜想与假设):①溶液呈酸性;②反应生成了碳酸氢钙.
(实验与结论):
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用玻璃棒蘸取沉淀溶解成澄清的溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照. | 测得被测液的pH=8 | 猜想①不成立. (填“成立”或“不成立”) |
| 实验Ⅱ:取沉淀溶解成澄清的溶液于另一支试管中,加入稀 盐酸. | 有气体产生 | 反应的化学方程式为: 2HCl+Ca(HCO3)2=CaCl2+2H2O+2CO2↑. 猜想②成立. |
(交流与反思):
从探究中你得到的启示或感受是不溶物在一定条件下可转化为可溶物.
 今年开春一路飙升的菜价让市场大呼意外,“蒜你狠”也再次发威.某报社记者在山东金乡等大蒜主产区调查发现,产量下降、市场供求是这波“蒜你狠”行情的决定性因素.
今年开春一路飙升的菜价让市场大呼意外,“蒜你狠”也再次发威.某报社记者在山东金乡等大蒜主产区调查发现,产量下降、市场供求是这波“蒜你狠”行情的决定性因素. 钢铁是使用最多的金属材料.
钢铁是使用最多的金属材料.