题目内容
7.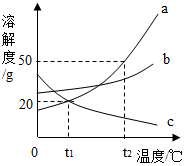 如图是三种固体物质的溶解度曲线,下列说法中正确的是( )
如图是三种固体物质的溶解度曲线,下列说法中正确的是( )| A. | a物质的饱和溶液变不饱和溶液,可以降低温度 | |
| B. | t2℃时,50g物质a与50g水充分混合后所得溶液的总质量为100g | |
| C. | t1℃时,a、c两物质溶液的溶质质量分数相等 | |
| D. | 分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为b>a>c |
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:A、a物质的饱和溶液变不饱和溶液,可以升高温度,错误;
B、t2℃时,a的溶解度为50g,50g物质a与50g水充分混合后,只能溶解25g,所得溶液的总质量为75g,错误;
C、t1℃时,a、c两物质饱和溶液的溶质质量分数相等,错误;
D、分别将t2℃时三种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数的大小关系为b>a>c,正确;
故选D.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列化学用语表达正确的是( )
| A. | 碳酸镁-MgCO3 | B. | 2个铁离子-2Fe+3 | C. | 氧化铝-AlO | D. | 3个氧原子-O3 |
18.某同学用一定量的氯酸钾制氧气,误将高锰酸钾当做二氧化锰加入,则其比只单独加热氯酸钾制氧气,说法正确的是( )
| A. | 反应速率加快,得到氧气量增多 | B. | 反应速率加快,得到氧气量不变 | ||
| C. | 反应速率不变,得到氧气量不变 | D. | 反应速率不变,得到氧气量增多 |
12.化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,结果同学们没有观察到明显现象,于是他们展开了如下探究.
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
同学们取少量大试管中的液体于另一支试管中,
(1)滴加,观察到有气泡冒出 证明二氧化碳与氢氧化钠发生了反应.
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】佳佳认为溶质是Na2CO3
贝贝认为溶质是Na2CO3和NaOH
【实验验证】贝贝为了验证自己的猜想,进行了如下实验,请你补充完整.
【实验反思】写出CO2与氢氧化钠反应的化学方程式:2NaOH+CO2=Na2CO3+H2O.
操作①中加入足量该溶液的目的是除去碳酸钠,防止碳酸根离子对氢氧根离子验证的干扰.
【实验拓展】同学们联想到了氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是稀硫酸中的水会稀释氢氧化钠,使pH值变小.当pH值小于等于7时,说明氢氧化钠消耗完毕,则说明氢氧化钠和稀硫酸反应.
除了测溶液的pH,更简便的方法是预先向氢氧化钠溶液中滴加酚酞试液,实验现象是溶液红色变为无色.
探究一:二氧化碳是否与氢氧化钠发生了化学反应?
同学们取少量大试管中的液体于另一支试管中,
(1)滴加,观察到有气泡冒出 证明二氧化碳与氢氧化钠发生了反应.
探究二:反应后大试管中的溶液所含溶质的成分是什么?
【提出猜想】佳佳认为溶质是Na2CO3
贝贝认为溶质是Na2CO3和NaOH
【实验验证】贝贝为了验证自己的猜想,进行了如下实验,请你补充完整.
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量大试管中的溶液于试管中,加入足量氯化钙;溶液,过滤 ②向滤液滴加适量酚酞. | ①白色沉淀产生,②溶液变红色 | 贝贝的猜想成立 |
操作①中加入足量该溶液的目的是除去碳酸钠,防止碳酸根离子对氢氧根离子验证的干扰.
【实验拓展】同学们联想到了氢氧化钠与稀硫酸发生中和反应也观察不到明显现象,为了确定其反应是否反生,有同学设计了如下的实验方案:先用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,边滴边测定混合溶液的pH.请你分析上述方案中,为什么要“当测定pH小于或等于7,”才可证明发生反应了,其原因是稀硫酸中的水会稀释氢氧化钠,使pH值变小.当pH值小于等于7时,说明氢氧化钠消耗完毕,则说明氢氧化钠和稀硫酸反应.
除了测溶液的pH,更简便的方法是预先向氢氧化钠溶液中滴加酚酞试液,实验现象是溶液红色变为无色.
19.小明在厨房中发现一种白色固体,他认为“可能是食盐”.小花说“可以尝一尝”.对于“可能是食盐”应属于科学探究中的( ),对于“可以尝一尝”这一过程应属于科学探究中的( )
| A. | 提出假设 | B. | 收集证据 | C. | 实验 | D. | 得出结论 |
16.实验是学习化学的一条重要途径,下列实验基本操作正确的是( )
| A. |  检查装置的气密性 | B. |  过滤 | ||
| C. |  读取液体体积 | D. |  加热液体 |
 甲~己是初中化学常见六种物质.它们之间的转化关系如图所示.已知甲和戌、丁和己的组成元素相同,且甲和戌都是气体.(部分反应物、产物及反应条件已略去.“→”表示物质之间能发生转化)
甲~己是初中化学常见六种物质.它们之间的转化关系如图所示.已知甲和戌、丁和己的组成元素相同,且甲和戌都是气体.(部分反应物、产物及反应条件已略去.“→”表示物质之间能发生转化)