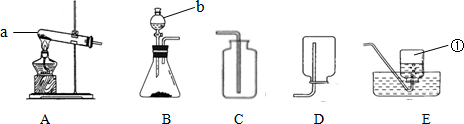题目内容
7.金属在生产生活中应用广泛.(1)下列金属制品中,利用金属导热性的是AB.(填序号)

(2)新买来的轴承表面都涂有一层机油,其目的是使铁与氧气和水隔绝,防止生锈.
(3)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生的化学方程式为Fe+CuSO4=Cu+FeSO4.
(4)实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染.于是几位同学设计实验处理废液,回收工业重要原料硫酸锌和有关金属.实验过程如下:

请回答:
Ⅰ.操作①的名称是过滤.
Ⅱ.步骤①中加入过量M的化学式Zn.请写出工业上用赤铁矿(主要成分为Fe2O3)炼铁的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
Ⅲ.若加入一定量M(不考虑上述实验过程中后续实验现象和结论),则滤液A中一定含有的溶质的化学式是ZnSO4.
分析 (1)根据金属材料的性质和用途分析回答;
(2)根据铁生锈的条件分析解答;
(3)根据铁与硫酸铜的反应分析回答;
(4)根据金属活动性顺序表的应用分析判断有关的问题.
解答 解:(1)铜火锅和不锈钢炒锅是利用了金属的导热性;
(2)新买来的轴承表面都涂有一层机油,其目的是使铁与氧气和水隔绝,防止生锈.
(3)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,是由于铁的金属活动性比铜强,铁可以置换出硫酸铜中的铜,铜是红色物质,所以反应后可留下红色痕迹,反应的化学方程式为:Fe+CuSO4=Cu+FeSO4;
(4)将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,回收工业重要原料硫酸锌和有关金属,应加入的过量的M是锌,锌先后与硫酸铜和硫酸亚铁反应生成了硫酸锌、铜和铁;过滤得到的溶液A是硫酸锌的溶液,固体A中含有铜、铁和锌,用磁铁吸附分离出铁,再加入稀硫酸得到了硫酸锌.过滤得到了铜.所以:
Ⅰ.操作①能固液分开,名称是过滤;
Ⅱ.由上述分析可知,步骤①中加入过量的M是锌,化学式是:Zn.工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
Ⅲ.若加入一定量M是锌,则滤液A中一定含有的溶质的化学式是:ZnSO4.
故答案为:(1)AB;
(2)氧气和水;
(3)Fe+CuSO4=Cu+FeSO4
(4)Ⅰ.过滤.
Ⅱ.Zn.Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
Ⅲ.ZnSO4.
点评 本题主要考查了金属的知识,了解金属的性质和用途以及金属活动性顺序表的应用是解答本题的基础.

 一课一练课时达标系列答案
一课一练课时达标系列答案
| A. | 设备1中发生的反应主要为SO2+H2O=H2SO3 | |
| B. | 流程图中能循环利用的物质是H2O | |
| C. | 设备3中反应前后各元素化合价均保持不变 | |
| D. | 该流程可有效减少酸雨的形成 |
| A. | 晶体质量不变 | B. | 晶体质量减少 | ||
| C. | 氯化钠溶解度增大 | D. | 溶液质量不变 |
| A. | 面粉是可燃物 | B. | 爆炸一定是化学变化 | ||
| C. | 燃烧爆炸的过程一定有能量的变化 | D. | 面粉厂中应严禁烟火 |

 哈尔滨师范大学有着洋气,大方的校园.校园内的“创意井盖”和“蓝精灵代步车”更是成了师大的一道靓丽的风景线.请回答:
哈尔滨师范大学有着洋气,大方的校园.校园内的“创意井盖”和“蓝精灵代步车”更是成了师大的一道靓丽的风景线.请回答: A、B、C、D为初中常见的四种不同类型的化合物.其中A为常见的钠盐,B常温下为气体,其固体常用于人工降雨,E是蓝色的硫酸盐溶液,它们之间关系如图.(图中“-”表示相互能反应,“→”表示转化关系.)
A、B、C、D为初中常见的四种不同类型的化合物.其中A为常见的钠盐,B常温下为气体,其固体常用于人工降雨,E是蓝色的硫酸盐溶液,它们之间关系如图.(图中“-”表示相互能反应,“→”表示转化关系.)